
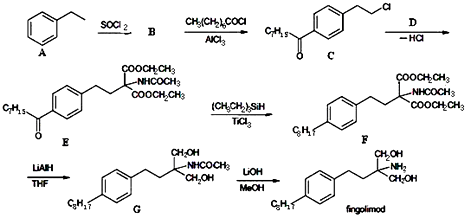
 .
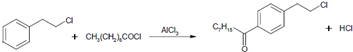
.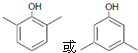 .
. 等主要原料,合成医药中间体:
等主要原料,合成医药中间体: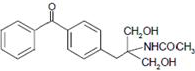 (无机原料任选).合成路线流程图示例如下:
(无机原料任选).合成路线流程图示例如下: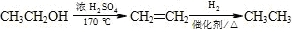
分析 (1)根据C的结构简式知,B到C是对位取代,A到B是Cl取代了A中甲基上的一个氢;根据C+D脱去一个HCl生成E推导D的结构简式;
(2)根据化合物fingolimod结构简式判断含氧官能团;
(3)根据C的结构简式知,B到C是对位取代,据此书写方程式;
(4)根据流程E→F,F→G中结构中官能团的变化判断,(CH3CH2)3SiH和LiAlH4的作用;
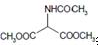
(5)B为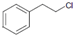 水解产物为
水解产物为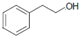 ,①遇FeCl3溶液发生显色反应,说明含有酚羟基;②分子中有4中化学环境不同的氢原子③苯环上一溴代物有2种,则一般为对称结构,据此分析书写;
,①遇FeCl3溶液发生显色反应,说明含有酚羟基;②分子中有4中化学环境不同的氢原子③苯环上一溴代物有2种,则一般为对称结构,据此分析书写;
(6)根据合成医药中间体: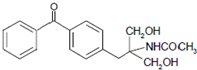 ,则需要将
,则需要将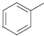 、
、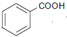 连起来,参考流程图中B转化成C,只要在
连起来,参考流程图中B转化成C,只要在 、
、 分别引入Cl即可;最终再结合F转化成G的完成最后合成.
分别引入Cl即可;最终再结合F转化成G的完成最后合成.
解答 解:(1)由C的结构简式知,B到C是对位取代,A到B是Cl取代了A中甲基上的一个氢;又C+D脱去一个HCl生成E,则D的结构简式为E+HCl-C得:CH3CONHCH(COOC2H5)2,
故答案为:取代反应;CH3CONHCH(COOC2H5)2;
(2)由化合物fingolimod结构简式,则含氧官能团的名称为羟基,
故答案为:羟基;
(3)由C的结构简式知,B到C是对位取代,方程式为 ,
,
故答案为: ;
;
(4)由流程E→F、F→G中结构中官能团中碳氧双键变成了单键,则(CH3CH2)3SiH和LiAlH4的作用为还原剂,
故答案为:还原;
(5)B为 水解产物为
水解产物为 ,①遇FeCl3溶液发生显色反应,说明含有酚羟基;②分子中有4中化学环境不同的氢原子③苯环上一溴代物有2种,则一般为对称结构;所以符合条件的同分异构体为:
,①遇FeCl3溶液发生显色反应,说明含有酚羟基;②分子中有4中化学环境不同的氢原子③苯环上一溴代物有2种,则一般为对称结构;所以符合条件的同分异构体为: ,
,
故答案为: ;
;
(6)根据合成医药中间体: ,则需要将
,则需要将 、
、 连起来,参考流程图中B转化成C,只要在
连起来,参考流程图中B转化成C,只要在 、
、 分别引入Cl,即
分别引入Cl,即 光照取代,
光照取代, 发生信息反应,最终再结合F转化成G的完成最后合成;所以流程为:
发生信息反应,最终再结合F转化成G的完成最后合成;所以流程为: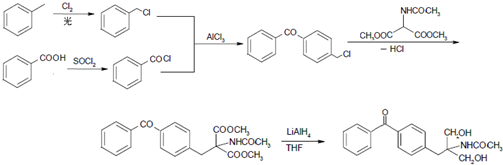 ,
,
故答案为: .
.
点评 本题考查有机物的推断与合成、官能团、同分异构体书写等,难度中等,注意根据题目流程中转化关系与反应信息进行(6)中合成路线的设计.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
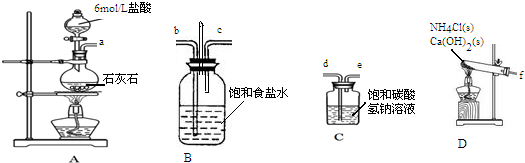 制备碳酸氢钠,然后用碳酸氢钠制备碳酸钠.
制备碳酸氢钠,然后用碳酸氢钠制备碳酸钠.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | O22-与S2-具有相同的质子数和电子数 | |
| B. | H、D、T互为同位素,H2O、D2O、T2O互为同素异形体 | |
| C. | 碱金属元素是指 IA族的所有元素 | |
| D. | 周期表中第15列元素的最高价氧化物对应水化物的化学式均为H3RO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
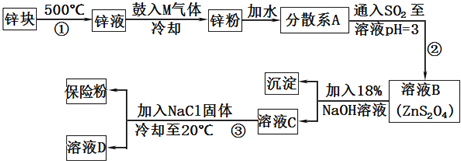
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
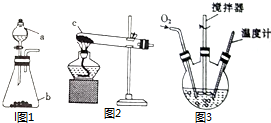 氯化亚铜(CuCl)是微溶于水但不溶于乙醇的白色粉末,溶于浓盐酸会生成HCuCl2,常用作催化剂.实验室可用废铜屑、浓盐酸、食盐及氧气制取CuCl.已知KMnO4不与稀盐酸反应,回答下列问题:
氯化亚铜(CuCl)是微溶于水但不溶于乙醇的白色粉末,溶于浓盐酸会生成HCuCl2,常用作催化剂.实验室可用废铜屑、浓盐酸、食盐及氧气制取CuCl.已知KMnO4不与稀盐酸反应,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径X>Y>Z | |
| B. | 最高价氧化物的水化物酸性从强到弱的顺序是HXO4>H2YO4>H3ZO4 | |
| C. | 气态氢化物的稳定性按X、Y、Z顺序由弱到强 | |
| D. | 阴离子的氧化性按Z、Y、X顺序由强到弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 鸡蛋壳溶于食醋:CaCO3+2CH3COOH→(CH3COO)2Ca+H2O+CO2↑ | |
| B. | 苯酚钠溶液中通入少量CO2:CO2+H2O+2C6H5O-→2C6H5OH+CO32- | |
| C. | 向CH2BrCOOH中加入足量的氢氧化钠溶液并加热:CH2BrCOOH+OH-$\stackrel{△}{→}$CH2BrCOO-+H2O | |
| D. | 用银氨溶液检验乙醛中的醛基:CH3CHO+2Ag(NH3)2++2OH-$\stackrel{水浴加热}{→}$CH3COO-+NH4++3NH3+2Ag↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原电池是将电能直接转化成化学能的装置 | |
| B. | 比较不活泼的金属为负极,负极发生氧化反应 | |
| C. | 正极为电子流入的一极,有气泡产生 | |
| D. | 正极的电极反应式:Zn-2e-=Zn2+,溶液中SO42-向正极移动 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com