
| A. | 石油的分馏、煤的干馏都是物理变化 | |
| B. | 化学反应的限度是不可改变的 | |
| C. | 可用乙醇萃取溴水中的溴 | |
| D. | 在过渡元素中寻找催化剂和耐高温、耐腐蚀的合金材料 |
分析 A.煤的干馏生成煤焦油等;
B.化学反应的限度在外界条件改变时,可发生一定的变化;
C.乙醇与水互溶;
D.过渡元素区为金属元素.
解答 解:A.煤的干馏生成煤焦油等,为化学变化,而石油的分馏为物理变化,故A错误;
B.化学反应的限度在外界条件改变时,可发生一定的变化,如合成氨的反应,加压有利于氨的生成,故B错误;
C.乙醇与水互溶,不能作萃取剂,应选苯或四氯化碳萃取溴水中的溴,故C错误;
D.过渡元素区为金属元素,则在过渡元素中寻找催化剂和耐高温、耐腐蚀的合金材料,故D正确;
故选D.
点评 本题考查元素周期表的应用、混合物分离、化学反应的限度等,为高频考点,把握物质的性质及发生的反应、化学平衡移动、周期表的应用为解答的关键,侧重分析与应用能力的考查,综合性较强,题目难度不大.


 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
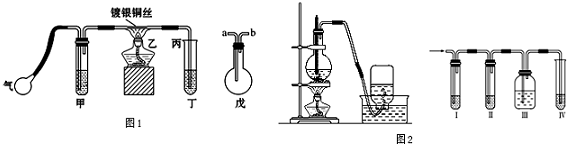
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 上述四种氧化物对应的水化物中,Al(OH)3酸性最强 | |
| B. | 向沉淀X中逐滴加入硝酸,沉淀慢慢溶解 | |
| C. | 溶液Y中的阳离子主要是Mg2+、Al3+、Fe3+、H+ | |
| D. | 溶液Y中加入过量氨水,所得沉淀为Fe(OH)3和Mg(OH)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10g46%的乙醇溶液所含氢原子数为1.2 NA | |
| B. | 0.5 mol Na2O2中含有的离子数目为2NA | |
| C. | 标准状况下,2.24 L甲醇中含有C-H键的数目为0.3NA | |
| D. | S2和S8的混合物共38.4 g,其中所含硫原子数为1.4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
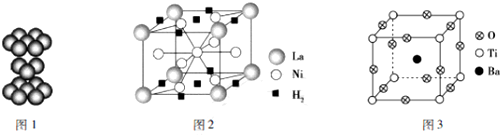
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
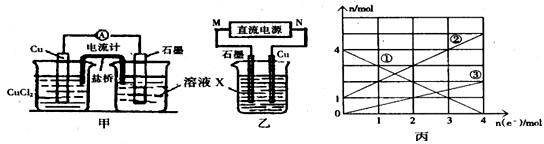
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
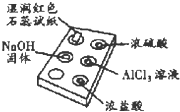 利用点滴板探究氨气的性质(如图所示).实验时向NaOH 固体上滴几滴浓氨水后,立即用表面皿扣住点滴板.下列对实验现象的解释正确的是( )
利用点滴板探究氨气的性质(如图所示).实验时向NaOH 固体上滴几滴浓氨水后,立即用表面皿扣住点滴板.下列对实验现象的解释正确的是( )| 选项 | 实验现象 | 解释 |
| A | 湿润红色石蕊试纸变蓝 | NH3极易溶于水 |
| B | 浓硫酸附近无白烟 | NH3与浓硫酸不发生反应 |
| C | 浓盐酸附近产生白烟 | NH3与挥发出的HCl反应:NH3+HCl═NH4Cl |
| D | AlCl3溶液变浑浊 | NH3与AlCl3溶液反应:Al3++3OH═Al(OH)3↓ |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com