
| 实 验 步 骤 | 解 释 或 实 验 结 论 |
| (1)称取A 9.0g,升温使其汽化,测其密度是相同条件下H2的45倍. | 试通过计算填空:(1)A的摩尔质量为:90. |
| (2)将此9.0g A在足量纯O2充分燃烧,并使其产物依次缓缓通过浓硫酸、碱石灰,发现分别增重5.4g和13.2g. | (2)A的分子式为 :C3H6O3. |
| (3)另取A 9.0g,跟足量的NaHCO3粉末反应,生成2.24L CO2(标准状况),若与足量金属钠反应则生成2.24L H2(标准状况). | (3)A中含有官能团的名称: 羧基、羟基. |
(4)A的核磁共振氢谱如图: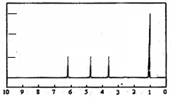 | (4)A中含有1个手性碳原子. |
(5)综上所述,A的结构简式为: . . | |
分析 (1)同温同压下,气体的密度之比等于相对分子质量之比,据此计算;
(2)浓硫酸增重7.2g为水的质量,碱石灰增重17.6g为二氧化碳质量,计算有机物、水、二氧化碳物质的量,进而计算n(H)、n(C),根据质量守恒确定是否含有O元素,根据元素守恒来确定有机物的分子式;
(3)能与足量的NaHCO3粉末反应,说明含有-COOH,根据生成的二氧化碳的物质的量确定-COOH数目,能与钠反应生成氢气,结合生成氢气的物质的量确定是否含有-OH及羟基数目;
(4)核磁共振氢谱图中有几个峰值则含有几种类型的等效氢原子,峰面积之比等于氢原子的数目之比,确定结构简式,可确定手性碳原子数目;
(5)由A的分子式、含有的官能团及核磁共振氢谱书写其结构简式.
解答 解:(1)由其密度是相同条件下H2的45倍,可知A的相对分子质量为45×2=90,
故答案为:90;
(2)由题意可推知:n(A)=$\frac{9.0g}{90g/mol}$=0.1 mol,n(C)=n(CO2)=$\frac{13.2g}{44g/mol}$=0.3 mol,n(H)=2n(H2O)=2×$\frac{5.4g}{18g/mol}$=0.6 mol,
n(O)=$\frac{9g-0.3×12g-0.6×1g}{16g/mol}$=0.3 mol,
所以A的分子式为:C3H6O3,
故答案为:C3H6O3;
(3)0.1 mol A与NaHCO3反应放出0.1 mol CO2,则说A中应含有一个羧基,而与足量金属钠反应则生成0.1 mol H2,说明A中还含有一个羟基,
故答案为:羧基、羟基;
(4)核磁共振氢谱中有4个吸收峰,面积之比为1:1:1:3,可知A中应含有4种不同环境的氢原子,共含有3个C原子,其中1个为甲基、一个为羧基,则只有一个手性碳原子,
故答案为:1;
(5)综上所述,A的结构简式为: ,
,
故答案为: .
.
点评 本题考查有机物的推断,为高频考点,侧重于学生的分析、计算能力的考查,题目难度中等,注意掌握常见有机物结构与性质,根据A和碳酸氢钠、钠反应时生成气体体积判断含有的官能团类型为解答关键.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 同浓度、同体积的强酸与强碱溶液混合后,溶液的 pH=7 | |
| B. | 0.1 mol•L-1 NH4Cl 溶液与 0.1 mol•L-1氨水等体积混合(pH>7):c(NH3•H2O)>c(NH4+)>c(Cl-)>c(OH-) | |
| C. | 0.1 mol AgCl 和 0.1 mol AgI 混合后加入水中,所得溶液 c(Cl-)=c(I-) | |
| D. | 向 0.10 mol•L-1 Na2SO3溶液中通 SO2气体至溶液 pH=7:c(Na+)<2[c(SO23-)+c(HSO3-)+c(H2SO3)] |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 结晶牛胰岛素 | B. | 氰酸铵 | C. | 葡萄糖 | D. | 尿素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氧化钠溶液与稀硫酸的反应 | |
| B. | Ba(OH)2•8H2O晶体与NH4Cl晶体的反应 | |
| C. | 甲烷在空气中燃烧的反应 | |
| D. | 灼热的木炭与CO2的反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验内容 | 实验现象 | 有关反应的方程式或结论 |
| ①取磨光后镁条与铝条,分别投入稀盐酸中 | Mg+2HCl=MgCl2+H2↓ 2Al+6HCl=2AlCl3+3H2↓ 说明金属性的强弱顺序为:Mg>Al | |
| ②向MgCl2、AlCl3溶液中分别逐滴滴入NaOH溶液至过量 | 与MgCl2溶液反应产生白色沉淀,与AlCl3溶液反应先产生白色沉淀,而后沉淀完全溶解 | AlCl3溶液与NaOH溶液反应的化学方程式:AlCl3+3NaOH=Al(OH)3↓+3NaCl,Al(OH)3+NaOH=NaAlO2+2H2O |
| ③向新制的Na2S溶液中滴入新制的氯水 | 生成淡黄色的沉淀 | 反应的化学方程式为:Na2S+Cl2=S↓+2NaCl |
| ④向各为1mol/L的H2SO4、H3PO4溶液中投入镁条 | 镁与H2SO4反应更剧烈,迅速产生大量无色气体 | 说明非金属性的强弱顺序为:S>P |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向水中加入KHSO4溶液,平衡逆向移动,Kw减小 | |
| B. | 将水加热,Kw增大,pH减小,但还是中性 | |
| C. | 向水中加入少量CH3COONa固体,平衡逆向移动,c(H+)降低 | |
| D. | 向水中加入AlCl3溶液,平衡向右移动,KW增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
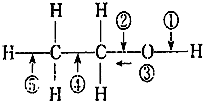
| A. | 和金属钠反应时断裂① | |
| B. | 乙醇燃烧时断裂②和⑤ | |
| C. | 在银催化条件下,与O2反应时断裂①和③ | |
| D. | 和浓H2SO4、乙酸共热时断裂①,其他键不变化 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com