
| A、a mol X+a mol Y |
| B、2a mol Z |
| C、a mol X+a mol Z |
| D、a mol Y+a mol Z |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
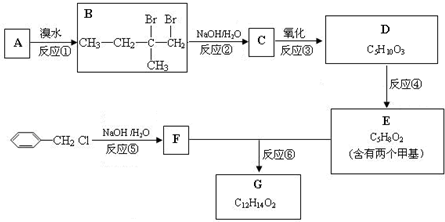
查看答案和解析>>
科目:高中化学 来源: 题型:

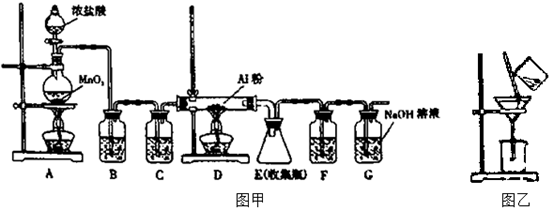
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| 化学反应及平衡常数 | 平衡常数数值 | ||
| 500℃ | 800℃ | ||
| ①2H2O(g)+CO(g)?CH3OH(g) | K1 | 2.5 | 0.15 |
| ②H2(g)+CO2(g)?H2O(g)+CO(g) | K2 | 1.0 | 2.50 |
| ③3H2(g)+CO2(g)?CH3OH(g)+H2O(g) | K3 | 2.5 | 0.375 |
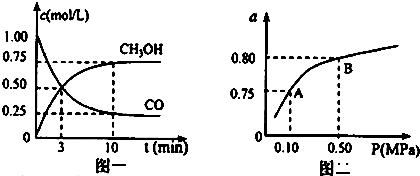
查看答案和解析>>
科目:高中化学 来源: 题型:
A、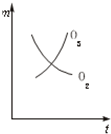 |
B、 |
C、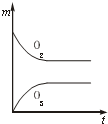 |
D、 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、中和滴定时,用待测溶液润洗锥形瓶 |
| B、使用pH试纸测定溶液pH时先润湿,则测得溶液的pH一定偏小 |
| C、用酸式滴定管量取12.00 mL高锰酸钾溶液 |
| D、在配制的硫酸亚铁溶液常加入一定量的铁粉和盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、水晶项链和餐桌上的瓷盘都是硅酸盐制品 |
| B、形成酸雨的氧化物主要是SO2和氮的氧化物,CO2是造成温室效应的主要气体 |
| C、欲提高氯水中HClO的浓度可往氯水加适量的碳酸钙粉末 |
| D、大气中的N2可转化为NO,NO可转化为NO2、硝酸等;含硫物质在自然界中可转化为SO2等含硫化合物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com