
| A. | 常温常压下,1.7g NH3所含的电子数为0.8NA | |
| B. | 标准状况下,11.2L SO2所含的氧原子数为1.5NA | |
| C. | 1mol Fe与足量的稀硝酸反应,转移的电子总数为3NA | |
| D. | 0.1mol•L-1的Na2CO3溶液中含有的钠离子数为0.2NA |
分析 A.质量转化为物质的量结合1个氨气分子含有10个电子;
B.依据n=$\frac{V}{Vm}$=$\frac{N}{N{\;}_{A}}$结合1个二氧化硫含有2个氧原子解答;
C.铁与足量稀硝酸反应 生成硝酸铁;
D.溶液体积未知.
解答 解:A.常温常压下,1.7g NH3所含的电子数为$\frac{1.7g}{17g/mol}$×10×NA=NA,故A错误;
B.标准状况下,11.2L SO2所含的氧原子数为$\frac{11.2L}{22.4L/mol}$×2×NA=NA,故B错误;
C.铁与足量稀硝酸反应 生成硝酸铁,1mol Fe与足量的稀硝酸反应1mol三价铁离子,转移的电子总数为3NA,故C正确;
D.溶液体积未知,无法计算微粒个数,故D错误;
故选:C.
点评 本题考查阿伏加德罗常数的有关计算和判断,注意掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,明确标况下气体摩尔体积的使用条件,题目难度不大.


 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 22Ne的质子数为12 | B. | 20Ne和22Ne的中子数相同 | ||
| C. | 20Ne和22Ne的质量数相同 | D. | 20Ne和22Ne互为同位素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | PM 2.5是指大气中直径小于或等于2.5微米的颗粒物,与肺癌、哮喘等疾病的发生密切相关,是造成雾霾天气的主要原因 | |
| B. | 海洋植物具有富集碘的能力,因此从海产品中提取碘是工业上获取碘的重要途径,工业上从海带中提取碘经历的步骤有:灼烧→浸泡→过滤→萃取→粗碘提纯 | |
| C. | 海水淡化的方法有蒸馏法、电渗析法等 | |
| D. | 用活性炭为糖浆脱色和用次氯酸盐漂白纸浆的原理不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 .
. ,其分子中含(填“含”或“不含”)σ键,不含(填“含”或“不含”)π键.
,其分子中含(填“含”或“不含”)σ键,不含(填“含”或“不含”)π键.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 已知A-+H2B(过量)=HA+HB-,则结合H+的能力:HB-<A-<B2- | |
| B. | 在0.1 mol•L-1的氨水中滴加0.1 mol•L-1盐酸,恰好完全中和时,c(NH4+)+c(NH3•H2O)=0.05mol•L-1 | |
| C. | 将c mol•L-1 的醋酸溶液与0.02 mol•L-1NaOH溶液等体积混合后恰好呈中性,用含c的代数式表示CH3COOH的电离常数Ka=$\frac{2×1{0}^{-9}}{c-0.02}$ | |
| D. | 将0.2mol•L-1盐酸与0.1mol•L-1的KAlO2溶液等体积混合,溶液中离子浓度由大到小的顺序:c(Cl-)>c(K+)>c(Al3+)>c(H+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
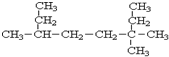 3,3,6-三甲基辛烷
3,3,6-三甲基辛烷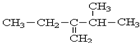 3-甲基-2-乙基-1-丁烯
3-甲基-2-乙基-1-丁烯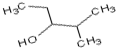 2-甲基-3-戊醇.
2-甲基-3-戊醇.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com