
| A. | 容器内气体颜色变浅,平均相对分子质量不变 | |
| B. | 平衡不移动,混合气体密度增大 | |
| C. | H2的转化率增大,HI平衡浓度变小 | |
| D. | 改变条件前后,速率图象如图 |
分析 向一体积不变的密闭容器中充入H2和I2,发生反应H2(g)+I2(g)?2HI(g)△H<0,当达到平衡后,t0时刻改变反应的某一条件,造成容器内压强增大,且混合气体总物质的量不变,故改变的条件为升高温度,升高温度正、逆反应速率均增大,但是逆反应速率大于正反应速率,反应逆向移动,以此来解答.
解答 解:A.容器内气体颜色变浅,平衡正向移动,混合气体的总质量不变,物质的量不变,故混合气体的平均相对分子质量不变,故A正确;
B.升高温度正、逆反应速率均增大,平衡向正反应移动,质量、体积不不变,则密度不变,故B错误;
C.平衡向正反应移动,I2(g)的转化率增大,HI平衡浓度增大,故C错误;
D.升高温度正、逆反应速率均增大,平衡正向移动,正反应速率大于逆向反应速率,与图象一致,故D正确;
故选AD.
点评 本题考查化学反应速率与化学平衡的影响因素、化学平衡图象等,为高频考点,侧重考查学生的分析能力,注意判断改变的条件为升高温度是解题的关键,明确温度对平衡移动的影响即可解答,题目难度中等.


科目:高中化学 来源: 题型:选择题
| 选项 | 化学反应 | 离子方程式 | 判断及改正方法 |
| A | CaCO3和醋酸溶液反应 | CaCO3+2H+═Ca2++H2O+CO2↑ | 正确 |
| B | 向Ba(OH)2溶液中加H2SO4溶液 | Ba2++OH-+H++SO42-═BaSO4↓+H2O | 错误:OH-、H+、H2O的化学计量数应均为2 |
| C | 过量的浓氨水加入到AlCl3溶液中 | Al3++3NH3•H2O═3NH4++Al(OH)3↓ | 错误:应生成AlO2-、NH4+、H2O |
| D | 将铜片插入硝酸银溶液中 | Cu+Ag+═Cu2++Ag | 正确 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年四川省高一上10月月考化学试卷(解析版) 题型:选择题
如图锥形瓶中装满了c mol·L-1的Na2SO4溶液,经测定其中含有a mol SO42-,则锥形瓶容积为( )

A.a/c L B.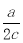 L C.ac L D.2ac L
L C.ac L D.2ac L
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 碳和碳的化合物在生产、生活中的应用非常广泛. 现将不同量的CO2(g)和H2(g)分别通入体积为2L的恒容密闭容器中,进行如下反应:CO2(g)+H2(g)?CO(g)+H2O(g),得到如下三组数据:
碳和碳的化合物在生产、生活中的应用非常广泛. 现将不同量的CO2(g)和H2(g)分别通入体积为2L的恒容密闭容器中,进行如下反应:CO2(g)+H2(g)?CO(g)+H2O(g),得到如下三组数据:| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | |
| CO2 | H2 | CO | |||
| 1 | 800 | 4 | 2.5 | 1.5 | 5 |
| 2 | 830 | 2 | 2 | 1 | 3 |
| 3 | 830 | 2 | 2 | 1 | 1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②⑥ | B. | ③④ | C. | ①②③④ | D. | ④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
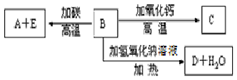 A、B、C、D、E代表单质或化合物,它们之间的相互转换关系如图所示.A为地壳中含量仅次于氧的非金属元素的单质.
A、B、C、D、E代表单质或化合物,它们之间的相互转换关系如图所示.A为地壳中含量仅次于氧的非金属元素的单质.查看答案和解析>>
科目:高中化学 来源:2016-2017学年四川省高一上10月月考化学试卷(解析版) 题型:选择题
在标准状况下,1体积水溶解672体积氨气,所得溶液密度为0.9g·cm-3,这种氨水的物质的量浓度和溶质的质量分数分别为( )
A.17.9mol·L-1 34.7% B.20.4mol·L-1 33.8%
C.17.9mol·L-1 33.8% D.20.4mol·L-1 34.7%
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com