
| A. | 常温常压下,0.05 NA 个 CO2 分子所占体积为 1.12 L | |
| B. | 标准状况时,22.4 L CH4 和CO2 的混合气体所含分子数为 NA | |
| C. | 500 mL 0.2 mol•L-1CaCl2 溶液中 Cl- 离子总数为 0.2 NA | |
| D. | NA 个 H2O 分子的质量与 H2O 的摩尔质量在数值上相等 |
分析 A、常温常压下,气体摩尔体积大于22.4L/mol;
B、气体的分子数N=$\frac{V}{Vm}{N}_{A}$;
C、求出氯化钙的物质的量,然后根据1mol氯化钙中含2mol氯离子来分析;
D、每摩尔物质所具有的质量为此物质的摩尔质量.
解答 解:A、常温常压下,气体摩尔体积大于22.4L/mol,故0.05NA个二氧化碳分子即0.05mol二氧化碳的体积大于1.12L,故A错误;
B、气体的分子数N=$\frac{V}{Vm}{N}_{A}$=$\frac{22.4L}{22.4L/mol}×{N}_{A}/mol$=NA个,故B正确;
C、溶液中氯化钙的物质的量n=CV=0.2mol/L×0.5L=0.1mol,而1mol氯化钙中含2mol氯离子,故0.1mol氯化钙中含0.2NA个氯离子,故C正确;
D、NA个水分子即1mol水的质量为18g,而水的摩尔质量为18g/mol,故两者在数值上相等,故D正确.
故选A.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.


 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用量筒量取液体时,视线与量筒内凹液面最低处保持水平 | |
| B. | 稀释浓硫酸时,把浓硫酸慢慢倒入盛有水的量筒中并搅拌 | |
| C. | 用胶头滴管向试管中加入液体时,胶头滴管紧贴试管内壁 | |
| D. | 检查容量瓶是否漏水的方法是往瓶中注入适量的水,倒转检查是否漏水即可 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ① | B. | ② | C. | ③ | D. | ④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CuFeS 2 仅作还原剂,硫元素被氧化 | |
| B. | 每生成1mol Cu2 S,有4 mol硫被氧化 | |
| C. | SO 2 只是氧化产物,FeS只是还原产物 | |
| D. | 每转移1.2 mol电子,有0.2mol硫被氧化 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
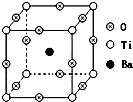 如图所示为PTC元件(热敏电阻)的主要成分--钡钛矿晶体结构,该结构是具有代表性的最小重复单位.该晶体经X射线分析鉴定,重复单位为正方体,边长a=403.1pm,顶点位置为Ti4+所占,体心位置为Ba2+所占,所有棱心位置为O2-所占.
如图所示为PTC元件(热敏电阻)的主要成分--钡钛矿晶体结构,该结构是具有代表性的最小重复单位.该晶体经X射线分析鉴定,重复单位为正方体,边长a=403.1pm,顶点位置为Ti4+所占,体心位置为Ba2+所占,所有棱心位置为O2-所占.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com