
某溶液中可能含有大量的Mg2+、Al3+、H+、Cl-和少量OH-,向该溶液中逐滴加入0.5 mol·L-1 NaOH溶液,生成沉淀的质量和加入NaOH溶液的体积之间的关系如下图所示,则可判断原溶液中 ( )。
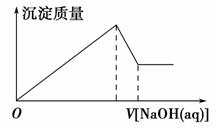
A.有Mg2+,没有Al3+ B.有Al3+,没有Mg2+
C.有Mg2+和Al3+ D.有大量的H+、Mg2+和Al3+
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
下列关于氯的说法正确的是 ( )。
A.Cl2具有很强的氧化性,在化学反应中只能作氧化剂
B .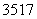 Cl、
Cl、 Cl为不同的核素,有不同的化学性质
Cl为不同的核素,有不同的化学性质
C.实验室制备Cl2可用排饱和食盐水集气法收集
D.1.12 L Cl2含有1.7 NA个质子(NA表示阿伏加德罗常数)
查看答案和解析>>
科目:高中化学 来源: 题型:
硝酸铜是一种重要的工业产品,化学上有很多方法可以制取硝酸铜:①将铜溶于硝酸中、②先将铜与O2反应生成CuO,再溶于硝酸中、③将铜溶于N2O4的乙酸乙酯(溶剂,不参加反应)溶液中生成硝酸铜和一氧化氮。下列认识或判断错误的是 ( )。
A.方法③是最经济和环保的
B.方法①中,若从经济和环保的角度考虑,用稀硝酸比用浓硝酸好
C.方法②需要消耗能源,对环境不产生污染
D.方法③中N2O4既是氧化剂又是还原剂
查看答案和解析>>
科目:高中化学 来源: 题型:
通过对实验现象的观察、分析推理得出正确的结论是化学学习的方法之一。对下列实验事实的解释正确的是 ( )。
| 操作、现象 | 解释 | |
| A | 向KI淀粉溶液中加入FeCl3溶液,溶液变蓝 | Fe3+能与淀粉发生显色反应 |
| B | 把生铁放置于潮湿的空气中,铁表面有一层红棕色的斑点 | 铁在潮湿的空气中易生成Fe(OH)3 |
| C | 向稀硝酸中加入少量铁粉,有气泡产生 | 说明Fe置换出硝酸中的氢,生成了氢气 |
| D | 新制Fe(OH)2露置于空气中一段时间,白色物质变成了红褐色 | 说明Fe(OH)2易被O2氧化成Fe(OH)3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
有一块镁铝合金,其中镁与铝的质量比是8∶9。加入足量稀H2SO4使其完全溶解后,再加入NaOH溶液,生成沉淀的质量随NaOH溶液体积变化的曲线如下图,其中正确的是 ( )。
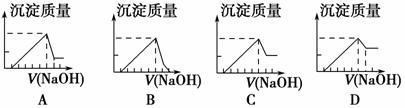
查看答案和解析>>
科目:高中化学 来源: 题型:
化学与科学、技术、社会、环境密切相关。下列有关说法中正确的是 ( )。
A.小苏打可用于生产玻璃,也可用来除去物品表面的油污
B.过氧化钠可用于食品、羽毛和织物等的漂白
C.医用酒精、次氯酸钠等消毒液均可以将病毒氧化而达到消毒的目的
D.使用含有氯化钠的融雪剂会加快桥梁的腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
120 mL含有0.20 mol碳酸钠的溶液和200 mL 盐酸,不管将前者滴加入后者,还是将后者滴加入前者,都有气体产生,但最终生成的气体体积不同,则盐酸的浓度合理的是 ( )。
A.2.0 mol·L-1 B.1.5 mol·L-1
C.0.18 mol·L-1 D.0.24 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
工业上从4J29合金(铁钴镍合金)废料中提取钴和镍,一般先用硫酸溶解合金使之成为Fe2+、Co2+、Ni2+,再把Fe2+氧化为Fe3+,从而使Fe3+转化为某种沉淀析出,达到与Ni2+、Co2+分离的目的。生产上要使Fe2+氧化为Fe3+,而不使Co2+、Ni2+被氧化的试剂是NaClO或NaClO3(均含少量H2SO4)溶液,反应的部分化学方程式如下(A为还原剂):
NaClO+A+B―→NaCl+C+H2O
NaClO3+A+B―→NaCl+C+H2O
(1)请完成以上化学方程式:________________________________________,________________________________________________。
实际生产中采用NaClO3来氧化Fe2+比较合算,其理由是_________________ _____________________________________________________________________________________________________________________________。
(2)配平下列离子方程式,并回答问题。
 Fe(OH)3+
Fe(OH)3+ ClO-+
ClO-+ OH-===
OH-=== FeO
FeO +
+ Cl-+
Cl-+ H2O
H2O
(3)已知有3.21 g Fe(OH)3参加反应,共转移了5.418×1022个电子,则n=________。
(4)根据上述(2)(3)题推测FeO 能与下列哪些物质反应________(只填序号)。
能与下列哪些物质反应________(只填序号)。
A.Cl2 B.SO2
C.H2S D.O2
查看答案和解析>>
科目:高中化学 来源: 题型:
YBa2Cu8Ox(Y为元素钇)是磁悬浮列车中的重要超导材料,关于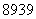 Y的说法不正确的是
Y的说法不正确的是
A.属于金属元素 B.质子数与中子数之差为50
C.原子的核外电子数是39 D.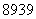 Y和
Y和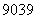 Y是两种不同的核素
Y是两种不同的核素
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com