

| ||
| ||
| 3 |
| 2 |
| 1 |
| 3 |
| 0.0198g |
| 0.02g |



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 ��ͼ�ǵ��CuCl2��Һ��װ�ã�����c��d��Ϊʯī�缫���������й��ж���ȷ���ǣ�������
��ͼ�ǵ��CuCl2��Һ��װ�ã�����c��d��Ϊʯī�缫���������й��ж���ȷ���ǣ�������| A��aΪ������bΪ���� |
| B��a������b���� |
| C���������У�������Ũ�Ȳ��� |
| D���������У�d�缫������һ���ɫ���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A���ƿ��Ա�����ú�ͻ����Ȼ�̼�� |
| B����¶���ڿ����б������ɵ���ɫ��Na2O |
| C�����ڿ�����ȼ�գ����ɰ�ɫ��Na2O2 |
| D������ˮ��Ӧ��ʵ�����˵����Ӳ��С���۵�͡��ܶȴ���ˮ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
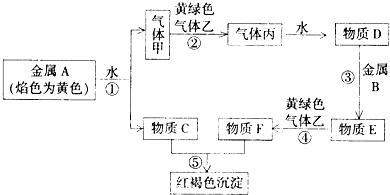
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| ||
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
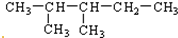
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
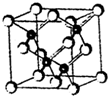 ��������ܣ�LED����Ƭ���ʻ�����GaAs���黯�أ���AlGaInP��������������lnGaN���������أ�Ϊ������֪������ͬ����һ���ڵ�Ԫ�أ��黯�صľ����ṹ��ͼ���Իش�
��������ܣ�LED����Ƭ���ʻ�����GaAs���黯�أ���AlGaInP��������������lnGaN���������أ�Ϊ������֪������ͬ����һ���ڵ�Ԫ�أ��黯�صľ����ṹ��ͼ���Իش��鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��0.1 mol��L-1 KNO3��Һ��H+��Fe2+��Cl-��SO42- |
| B��0.1mol��L-1 NaOH��Һ��Na+��Ca2+��I-��NH4+ |
| C��������Һ��Fe3+��Al3+��NO3-��SO42- |
| D��c��H+��ˮ����=10-12 mol?L-1����Һ��Ba2+��Na+��Cl-��NO3- |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com