

分析 (1)电子跃迁本质上是组成物质的粒子(原子、离子或分子)中电子的一种能量变化.如激光、焰色反应、原子光谱都与电子跃迁有关;
(2)A、B两种短周期元素,A是原子半径最小的元素为H元素,B原子最外层电子数是次外层的两倍为C元素.平面正六边形分子为苯分子,据此分析解答;
(3)①根据铬的基态原子中最外层电子数找出与其相同周期的最外层电子数为2的副族元素;
②中心原子的杂化类型为sp3,说明该分子中心原子的价层电子对个数是4,价层电子对个数=σ键个数+孤电子对个数,σ键个数=配原子个数,孤电子对个数=$\frac{1}{2}$×(a-xb),a指中心原子价电子个数,x指配原子个数,b指配原子形成稳定结构需要的电子个数;
(4)配位键有提供孤电子对的原子指向提供空轨道的离子;
(5)①1,3,5,6代表氧原子,2,4代表B原子,2号B形成3个键,则B原子为SP2杂化,4号B形成4个键,则B原子为SP3杂化; B一般是形成3个键,4号B形成4个键,其中1个键很可能就是配位键,配位键存在4号与5号之间,结合化合价代数和为0的原则判断;
②注意题目要求,钠离子与Xm-形成离子键,结晶水分子间存在氢键和范德华力;
(6)硼酸和金属镁为原料可制备单质硼,反应生成MgO、硼与水.
解答 解:(1)A.电子跃迁产生光子与入射光子具有相关性.即入射光与辐射光的相位相同.如果这一过程能够在物质中反复进行,并且能用其他方式不断补充因物质产生光子而损失的能量.那么产生的光就是激光,与电子跃迁有关,故A错误;
B.当碱金属及其盐在火焰上灼烧时,原子中的电子吸收了能量,从能量较低的轨道跃迁到能量较高的轨道,但处于能量较高轨道上的电子是不稳定的,很快跃迁回能量较低的轨道,这时就将多余的能量以光的形式放出,因而能使火焰呈现颜色,与电子跃迁有关,故B错误;
C.原子光谱的产生是原子核电子发生能级跃迁的结果,与电子跃迁有关,故C错误;
D.燃烧放热是化学能转化为热能,与电子跃迁无关,故D正确;
E.石墨是层状结构,层间有自由移动的电子,与电子跃迁无关,故E正确.
故选DE;
(2)A、B两种短周期元素,A是原子半径最小的元素为H元素,B原子最外层电子数是次外层的两倍为C元素,该分子由C、H两种元素组成且原子个数比为1:1的平面正六边形分子为C6H6,分子中6个碳原子的电子都以sp2杂化轨道相互重叠,形成 6个碳碳σ键,又各以1个sp2杂化轨道分别跟氢原子的1s轨道进行重叠,形成6个σ键,共12个σ键,
故答案为:12;
(3)①铬是24号元素,核外电子排布式为1s22s22p63s23p63d54s1;同周期最外层排2个电子的元素有Sc、Ti、V、Mn、Fe、Co、Ni、Zn,属于副族元素有Sc、Ti、V、Mn、Zn五种,
故答案为:5;
②a:C6H6中C原子杂化轨道数=σ键数+孤对电子对数=3+0=3,所以采取sp2杂化;
b:CH3OH中C原子杂化轨道数=σ键数+孤对电子对数=4+0=3,所以采取sp3杂化;
c:甲醛(H2C=O)分子内碳原子价层电子对个数=3+$\frac{1}{2}$×(4-2×1-1×2)=3,形成3个σ键,无孤对电子,杂化方式为sp2杂化;
d:CS2分子碳原子的价层电子对是2,一个CS2分子中含有2个π键,C原子杂化轨道数=σ键数+孤对电子对数=2+0=2,所以碳原子采用SP杂化;
e:CCl4中碳原子价层电子对个数=4+$\frac{1}{2}$×(4-4×1)=4,所以C原子采用sp3杂化;
CS2分子碳原子的价层电子对是2,一个CS2分子中含有2个π键,C原子杂化轨道数=σ键数+孤对电子对数=2+0=2,所以碳原子采用SP杂化,是直线型分子,分子的键角是1800,
故答案为:b、e;1800;
(4)配合物离子[Cu(NH3)4]2+中Cu2+提供空轨道的原子、N原子提供孤电子对,N→Cu,故结构式为: ,
,
故答案为: ;
;
(5)①1,3,5,6代表氧原子,2,4代表B原子,2号B形成3个键,则B原子为SP2杂化,4号B形成4个键,则B原子为SP3杂化; B一般是形成3个键,4号B形成4个键,其中1个键很可能就是配位键,配位键存在4号与5号之间.观察模型,可知Xm-是(H4B4O9)m-,依据化合价H为+1,B为+3,O为-2,可得m=2,
故答案为:sp2杂化、sp3杂化;2;
②钠离子与Xm-形成离子键,结晶水分子间存在氢键和范德华力,
故答案为:BCD.
(6)硼酸和金属镁为原料可制备单质硼,反应生成MgO、硼与水,反应方程式为:2H3BO3$\frac{\underline{\;\;△\;\;}}{\;}$B2O3+3H2O,B2O3+3Mg $\frac{\underline{\;\;△\;\;}}{\;}$2B+3MgO,
故答案为:2H3BO3$\frac{\underline{\;\;△\;\;}}{\;}$B2O3+3H2O;B2O3+3Mg $\frac{\underline{\;\;△\;\;}}{\;}$2B+3MgO.
点评 本题考查了电子跃迁的本质、原子的核外电子排布式的书写、杂化的应用、电离能、配位键等知识点,注意掌握构造原理书写基态原子核外电子排布式,掌握常见的与电子跃迁有关的现象、掌握杂化理论的应用、配位键的本质是解题的关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | C与D形成的化合物中只有离子键 | |
| B. | 由C、D、E三元素形成的化合物与A、C、E三元素形成的化合物可能反应 | |
| C. | A、B、C形成的化合物一定不能发生水解反应 | |
| D. | E的氧化物对应的水化物一定为强酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 工业上用电解熔融氧化物的方法制备C单质 | |
| B. | 离子半径:C>D | |
| C. | 熔融它们的单质,所克服的微粒间作用力都相同 | |
| D. | 含D的盐溶液都显酸性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4Cl的电子式: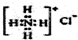 | |
| B. | HClO的结构式为:H-Cl-O | |
| C. | 氯化镁的电子式: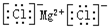 | |
| D. | 用电子式表示氯化氢分子的形成过程: |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
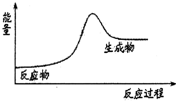
| A. | H2在Cl2中燃烧 | B. | Ba(OH)2•8H2O和NH4Cl固体的反应 | ||
| C. | Na和H2O的反应 | D. | 生石灰溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2H2+O2═2H2O△H=-571.6 kJ/mol | B. | H2(g)+$\frac{1}{2}$O2(g)═H2O(g )△H=-285.8kJ/mol | ||
| C. | 2H2(g)+O2(g)═2H2O(l)△H=-571.6 kJ/mol | D. | 2H2(g)+O2(g)═2H2O(l)△H=+571.6 kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
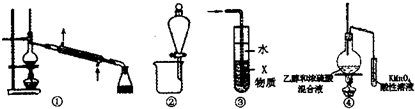
| A. | 装置①可用于石油的分馏 | |
| B. | 装置②可用于苯提取溴水中的Br2 | |
| C. | 装置③中X若为四氯化碳,可用于吸收氨气或氯化氣,并防止倒吸 | |
| D. | 装置④验证乙烯的生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 最高价氧化物的水化物显酸性 | B. | 非金属性比溴强 | ||
| C. | 原子序数为24 | D. | 氢化物比H2S稳定 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com