
| A、生成的氢气中只含有D2 |
| B、生成的氢气中只含有H2 |
| C、生成的氢气中含有H2、HD、D2 |
| D、以上判断都不正确 |


科目:高中化学 来源: 题型:
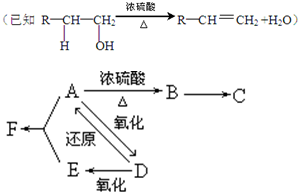
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1-溴丁烷 |
| B、2,2-二甲基-3-溴丁烷 |
| C、3-氯戊烷 |
| D、2-甲基-3-氯戊烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素代号 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
| 原子半径(nm) | 0.186 | 0.160 | 0.152 | 0.143 | 0.110 | 0.099 | 0.075 | 0.074 |
| 主要化合价 | +1 | +2 | +1 | +3 | +5、-3 | +7、-1 | +5、-3 | -2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、肯定有A13+、Mg2+、Cl- |
| B、肯定有A13+、Mg2+、NH4+ |
| C、肯定有K+、HCO3-、MnO4- |
| D、肯定有A13+、Mg2+、SO42- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com