
选做[物质结构与性质](10分)
已知X、Y、Z、Q、E五种元素的原子序数依次增大,其中X原子核外电子有6种不同的运动状态,s能级电子数是P能级电子数的两倍;Z原子L层上有2对成对电子;Q是第三周期中电负性最大的元素;E+的M层3d轨道电子全充满。请回答下列问题:
(1)X、Y、Z第一电离能由小到大的顺序为______ <______<______ (填元素符号)。
<______<______ (填元素符号)。
(2)E元素基态原子的电子排布式为________________________________。
(3)XZ2的分子中含有 个π键。
(4)Z氢化物的沸点比Q氢化物的沸点高,理由是____________ 。
(5)将YH3通入灼热EZ中发现黑色固体变红色,生成物对大气不造成污染。请写出有关化学方程式 。
(1)C<O<N (2) ls22s22p63s23p63d104s1 (3) 2
(4)H2O分子间能形成氢键,HCl分子间不能形成氢键
(5)3CuO+2NH3 3Cu+3H2O+N2(要加热条件)
3Cu+3H2O+N2(要加热条件)
【解析】
试题分析:X原子核外电子有6种不同的运动状态,即X原子有6个电子,所以X是C元素;Z原子L层上有2对成对电子,则L层电子数是6个,所以Z是O元素,则Y是N元素;Q是第三周期中电负性最大的元素,第三周期电负性最大的元素是Cl,则Q是Cl元素;E+的M层3d轨道电子全充满,则E元素原子的最外层是4s1,则E是Cu元素。
(1)同周期元素的第一电离能随核电荷数的增加而增大,但N元素原子的2p轨道是3个电子,为半充满的稳定状态,则N>O,所以X、Y、Z第一电离能由小到大的顺序为C<O<N;
(2)Cu元素核外有29个电子,根据电子的排布规律,Cu基态原子的电子排布式为ls22s22p63s23p63d104s1;
(3)CO2分子中,C与O原子之间形成C=O双键,所以共有2个π键;
(4)O氢化物的沸点比Cl氢化物的沸点高,是因为水分子间存在氢键,使沸点升高;
(5)将NH3通入灼热CuO中发现黑色固体变红色,生成物对大气不造成污染,则红色固体为Cu,其余产物为氮气和水,所以反应的化学方程式为3CuO+2NH3 3Cu+3H2O+N2。
3Cu+3H2O+N2。
考点:考查元素的推断,物质结构与性质的应用


 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案科目:高中化学 来源:2014-2015湖南省高一上学期期中考试化学试卷(解析版) 题型:选择题
下列反应属于氧化还原反应的是
A.CaCO3+2HCl=CaCl2+CO2↑ + H2O B.CaO+H2O=Ca(OH)2
C.2H2O2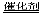 2H2O+O2↑ D.CaCO3
2H2O+O2↑ D.CaCO3 CaO+CO2↑
CaO+CO2↑
查看答案和解析>>
科目:高中化学 来源:2014-2015湖南省高二上学期期中化学(文)试卷(解析版) 题型:选择题
绿色食品是日渐为人们所熟悉社会概念.基本标准有如下几种说法:①香甜可口;②无污染;③表面呈绿色;④无化学添加剂;⑤有营养价值.其中符合要求是
A.①②③⑤ B①③④⑤ C.②④⑤ D.全部
查看答案和解析>>
科目:高中化学 来源:2014-2015河北省高二上学期第三次月考化学试卷(解析版) 题型:选择题
主链含5个碳原子,有甲基、乙基2个支链的烷烃有
A.2种 B.3种 C.4种 D.5种
查看答案和解析>>
科目:高中化学 来源:2014-2015河北省高二上学期第三次月考化学试卷(解析版) 题型:选择题
某有机化合物的结构简式如下:
 。
。
此有机化合物属于
①烯烃 ②多官能团有机化合物 ③芳香烃 ④烃的衍生物 ⑤高分子化合物 ⑥芳香族化合物
A.①②③④⑥ B.②④⑥ C.②④⑤⑥ D.①③⑤
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省高三上学期第四次月考化学试卷(解析版) 题型:选择题
下列叙述正确的是
A.在某反应中,当反应物具有的总能量大于生成物具有的总能量时,该反应吸热
B.同温同压下,4Al(s)+3O2(g)===2Al2O3(s)在常温和点燃条件下的ΔH不同
C.稀溶液中:H+(aq)+OH- (aq) ===H2O(l);ΔH=-53.7KJ/mol ,若将含0.5 mol H2SO4的浓溶液与含1 mol NaOH的溶液混合,放出的热量大于53.7kJ
D.由C(石墨)=== C(金刚石)△H= +1.90 kJ·mol-1 可知,金刚石比石墨稳定
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省高三上学期第四次月考化学试卷(解析版) 题型:选择题
由一种阳离子与两种酸根离子组成的盐称为混盐,混盐CaOCl2在酸性条件下可以产生Cl2,下列关于混盐CaOCl2的有关判断不正确的是
A.该混盐与稀硫酸反应产生1molCl2时转移2摩尔电子
B.该混盐的水溶液呈碱性
C.该混盐具有较强的氧化性
D.该混盐中氯元素的化合价为+1和-1
查看答案和解析>>
科目:高中化学 来源:2014-2015学年宁夏银川市高三上学期第三次月考理综试卷(解析版) 题型:填空题
选考[化学——选修2:化学与技术 ]( 15 分)
硫磺可用于生产化工原料硫酸。某工厂用下图所示的工艺流程生产硫酸。
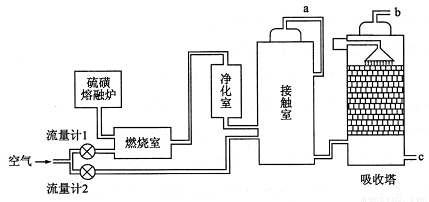
请回答下列问题:
(1)为充分利用反应放出的热量,接触室中应安装 (填设备名称)。吸收塔中填充有许多瓷管,其作用是 。
(2)为使硫磺充分燃烧,经流量计1通人燃烧室的氧气过量50 % ,为提高SO2 转化率,经流量计2的氧气量为接触室中二氧化硫完全氧化时理论需氧量的2.5倍,则生产过程中流经流量计 1 和流量计 2 的空气体积比应为 。 b 管排出的尾气的处理方法是 。
(3)与使用硫铁矿为原料的生产工艺相比,该工艺的特点是 。
A.耗氧量减少 B.二氧化硫的转化率提高
C.产生的废渣减少 D.不需要使用催化剂
(4)硫酸的用途非常广,可应用于下列哪些方面 。
A.橡胶的硫化 B.表面活性剂“烷基苯磺酸钠”的合成
C.铅蓄电池的生产 D.过磷酸钙的制备
(5)矿物燃料的燃烧是产生大气中SO2的主要原因之一。在燃煤中加人适量的石灰石,可有效减少煤燃烧时SO2的排放,请写出此脱硫过程中反应的化学方程式 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川省德阳市高三一诊考试化学试卷(解析版) 题型:选择题
已知溶液中:还原性HSO3->I-,氧化性IO3->I2>SO32-。向含3 mol NaHSO3的溶液中逐滴加入KIO3溶液,加入的KIO3和析出的I2的物质的量的关系曲线如右图所示,下列说法正确的是
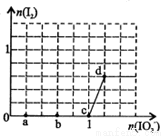
A.a点反应的还原剂是NaHSO3,被氧化的元素是碘元素
B.b点反应的离子方程式是:3HSO3-+IO3-+3OH-=3SO42-+I-+3H2O
C.c点到d点的反应中共转移0.6mol电子
D.往200mL 1 mol/L的KIO3溶液中滴加NaHSO3溶液,反应开始时的离子方程式是:5HSO3-+ 2IO3- =I2+5SO42-+3H++H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com