
| 离子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
| 浓度/mol•L-1 | 4×10-6 | 6×10-4 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
分析 (1)依据电荷守恒,求出氢离子的浓度,带入pH计算公式;
(2)①利用盖斯定律,通过已知热化学方程式运算得目标热化学方程式;
②依据二氧化硫的性质:是一种酸性氧化物可以和碱反应,二氧化硫溶于水得亚硫酸,酸性强于碳酸,所以可以和碳酸钠溶液反应;
(3)①列三段表示出各种物质平衡时的浓度,带入平衡常数表达式;N2(g)+O2(g)?2NO(g)△H>0,该反应是吸热反应,温度升高,反应速率加快,平衡向正方向移动,单位时间内产生的NO多;
②利用反应能否自发进行的判据△H-T△S;
③CO和NOx在催化剂的作用下发生氧化还原反应生成无毒的二氧化碳和氮气.
解答 解:(1)根据电荷守恒得:[H+]+[K+]+[Na+]+[NH4+]=2[SO42-]+[NO3-]+[Cl-],将表中数据带入得:[H+]=10-4,pH=-lg[H+]=4,溶液呈酸性,
故答案为:酸性;4;
(2)①H2(g)+$\frac{1}{2}$O2(g)=H20 (g)△H=-241.8kJ•mol-1 ①
C(s)+$\frac{1}{2}$O2(g)=CO (g)△H=-110.5kJ•mol-1②
利用盖斯定律将方程式变形:②-①得 C(s)+H2O(g)=H2(g)+CO(g)△H=+131.3kJ/mol,
故答案为:C(s)+H2O(g)=H2(g)+CO(g)△H=+131.3kJ/mol;
②二氧化硫是酸性氧化物所以具有酸性氧化物的通性能够与碱反应:SO2+Ca(OH)2=CaSO3↓+H2O;
二氧化硫水溶液是亚硫酸所以也能够与碳酸钠反应:SO2+Na2CO3=Na2SO3+CO2↑所以可以用氢氧化钙溶液和碳酸钠溶液做洗涤剂; 二氧化硫与氯化钙溶液不反应,且在亚硫酸氢钠溶液中的溶解度很小,所以不能用氯化钙和亚硫酸氢钠溶液做洗涤液,
故答案为:ab;
(3)①设反应容器的体积是aL
根据题意得:
N2(g)+O2(g)?2NO(g)
初始浓度 $\frac{0.8}{a}$ $\frac{0.2}{a}$ 0
转化浓度 $\frac{4×1{0}^{-4}}{a}$ $\frac{4×1{0}^{-4}}{a}$ $\frac{8×1{0}^{-4}}{a}$,
平衡浓度 $\frac{0.8}{a}$-$\frac{4×1{0}^{-4}}{a}$ $\frac{0.2}{a}$-$\frac{4×1{0}^{-4}}{a}$ $\frac{8×1{0}^{-4}}{a}$ 将各种物质的浓度带入表达式 得K=$\frac{[NO]^{2}}{[{N}_{2}][{O}_{2}]}$≈4×10-6,
气缸温度越高,单位时间内NO排放量越大,原因是温度升高,反应速率加快,平衡右移;
故答案为:4×10-6;温度升高,反应速率加快,平衡右移;
②2CO(g)=2C(s)+O2(g)是一个熵值减小的反应即:△S<0,同时又是一个△H>O,所以△H-T△S一定大于0,所以任何条件下不能自发进行,
故答案为:因为该反应的△H>0,△S<0,所以任何温度下均不自发进行;
③CO和NOx在催化剂发生反应:2CO+2N0$\frac{\underline{\;催化剂\;}}{\;}$2CO2+N2,故答案为:2CO+2N0$\frac{\underline{\;催化剂\;}}{\;}$2CO2+N2.
点评 本题考查了pH值的计算、盖斯定律求反应热、化学平衡常数的计算、反应进行方向的判断,题目综合性非常强,涉及知识点多,难度中等,同时又结合了环境的污染和治理,题目又比较新颖,是高考的热门话题,解题时应该结合相应的知识,认真解答.


 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 现代化学元素分析测试中,可用元素分析仪确定物质中是否含有C、H、O、N、S、Cl、Br等元素,用红外光谱仪确定物质中是否存在某些有机原子团,用原子吸收光谱确定物质中含有哪些金属元素等 | |
| B. | 钠钾合金在常温下是液体,可用于快中子反应堆作剂;镁合金大量用于制造火箭、导弹和飞机的部件等 | |
| C. | 2015年浙江省多地遭遇雾霾天气,有报道称雾霾颗粒中汽车尾气占20%以上,一致汽车尾气中的主要污染物为NOx、CO、燃烧源超细颗粒(PM2.5)等有害物质,其中PM2.5(OM单位为百万分之一米)颗粒大小约等于胶体粒子 | |
| D. | 如图所示为四大基本反应及其关系,则反应4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O属于区域3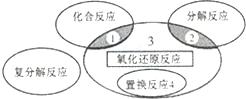 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 粒子半径:F-<Mg2+<Al3+ | B. | 热稳定性:HI>HBr>HCl>HF | ||
| C. | 酸性:H2SiO3<H3PO4<H2SO4<HClO4 | D. | 碱性:Al(OH)3>Mg(OH)2>NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氢气是一种清洁能源,氢气的制取与储存是氢能源利用领域的研究热点.
氢气是一种清洁能源,氢气的制取与储存是氢能源利用领域的研究热点.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
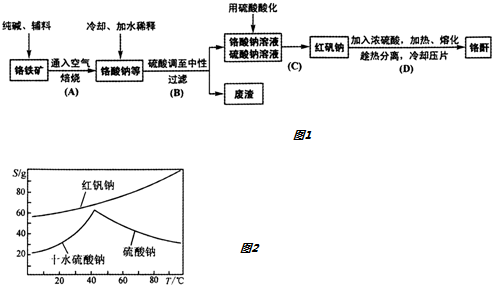
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某无色稀溶液X中,可能含有下表所列离子中的某几种.
某无色稀溶液X中,可能含有下表所列离子中的某几种.| 阴离子 | CO32-、SiO32-、AlO2-、Cl- |
| 阳离子 | Al3+、Fe3+、Mg2+、NH4+、Na+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 金属离子 | 开始沉淀的pH | 沉淀完全的pH |
| Fe3+ | 1.1 | 3.2 |
| Al3+ | 3.0 | 5.0 |
| Fe2+ | 5.8 | 8.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向硫酸铝溶液中加入过量氨水:Al3++3OH-=Al(OH)3↓ | |
| B. | 向Ba(OH)2溶液中滴加NaHSO4溶液至混合溶液恰好为中性:Ba2++OH-+H++SO42-=BaSO4↓+H2O | |
| C. | FeSO4溶液与稀硫酸、双氧水混合:2Fe2++H2O2+2H+=2Fe3++2H2O | |
| D. | 向NaHCO3溶液中加入足量Ba(OH)2的溶液:Ba2++2HCO3-+2OH-=2H2O+BaCO3↓+CO32- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com