
溴苯是一种常用的化工原料。实验室制备溴苯
的实验步骤如下:
步骤1:在a中加入15 mL苯和少量铁屑,再将b中4.0 mL
液溴慢慢加入到a中,充分反应。
步骤2:向a中加入10 mL水,然后过滤除去未反应的铁屑。
步骤3:滤液依次用10 mL水、8 mL 10%的NaOH溶液、10 mL 水洗涤,分液得粗溴苯。
 步骤4:向分出的粗溴苯中加入少量的无水氯化钙,静置、过滤即得粗产品。
步骤4:向分出的粗溴苯中加入少量的无水氯化钙,静置、过滤即得粗产品。
| 苯 | 溴 | 溴苯 | |
| 密度/g·cm-3 | 0.88 | 3.10 | 1.50 |
| 沸点/℃ | 80 | 59 | 156 |
| 在水中的溶解度 | 微溶 | 微溶 | 微溶 |
(1)仪器d的作用是 。
(2)将b中的液溴慢慢加入到a中,而不能快速加入的原因是 。
(3)仪器c的作用是冷凝回流,回流的主要物质有 (填化学式)。
(4)步骤4得到的粗产品中还含有杂质苯。已知苯、溴苯的有关物理性质如上表,则要进一步提纯粗产品,还必须进行的实验操作名称是 。
 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案科目:高中化学 来源: 题型:
能证明氯化氢是共价化合物的现象是 ( )
A. 氯化氢极易溶于水 B.液态氯化氢不能导电
C.氯化氢在水溶液中是完全电离的 D.氯化氢是无色气体且有味
查看答案和解析>>
科目:高中化学 来源: 题型:
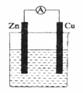
如图所示装置,烧杯中盛有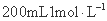 的CuSO4溶液。
的CuSO4溶液。
(1)负极电极反应式为________________;
正极电极反应式为____________________。
(2)若初始时Zn片与Cu片质量相等,实验结束后,称得两极质量差为12.9 g,则反应中转移电子的物质的量为________,反应后溶液中所含溶质的物质的量浓度为________(忽略溶液体积的变化)。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列共有十二种化学符号:
①O2 ②614C ③238U ④1123Na ⑤O3 ⑥714N ⑦1224Mg ⑧
⑨235U ⑩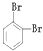 (11)
(11) (12)
(12)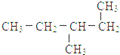
其中:
(1)表示核素的符号共有___种.
(2)互为同位素的是___(填序号,以下相同).
(3)质量数相等,但不能互称同位素的是___.
(4)中子数相等,但质子数不相等的是___.
(5)互为同素异形体的是___.
(6)互为同分异构体的是___.
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验中,所采取的分离方法与对应原理都正确的是( )
| 选项 | 目 的 | 分离方法 | 原 理 |
| A. | 分离溶于水中的碘 | 乙醇萃取 | 碘在乙醇中的溶解度较大 |
| B. | 分离乙酸乙酯和乙醇 | 分液 | 乙酸乙酯和乙醇的密度不同 |
| C. | 除去KNO3固体中混杂的NaCl | 重结晶 | NaCl在水中的溶解度很大 |
| D. | 除去丁醇中的乙醇 | 蒸馏 | 丁醇与乙醇的沸点相差较大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
N2O俗称“笑气”,医疗上曾用作可吸入性麻醉剂,下列反应能产生N2O:3 CO+2NO2=3CO2 +N2O。下列关于N2O的说法一定正确的是( )
CO+2NO2=3CO2 +N2O。下列关于N2O的说法一定正确的是( )
A.上述反应中,每消耗2mol NO2,就会生成22.4L N2O
B. 等质量的N2O和CO2含有相等的电子数
C. N2O有氧化性,且为HNO2的酸酐
D.N2O的氧化性强于NO2
查看答案和解析>>
科目:高中化学 来源: 题型:
[化学——选修2:化学与技术](14分)
纯碱(化学式为Na2CO3)是一种重要的化工原料。现代化工生产有三种工艺:
(一)布兰制碱法。以食盐为原料制碱,该法分三步:
①用氯化钠与硫酸反应制硫酸钠:2NaCl+H2SO4=Na2SO4+2HCl;
②用焦炭还原硫酸钠得硫化钠:Na2SO4+4C=Na2S+4CO↑
③用硫化钠与石灰石反应制碳酸钠:Na2S+CaCO3=Na2CO3+CaS
(二)氨碱法即索尔维制碱法。以食盐、氨、二氧化碳为原料,其反应也分三步进行:
①NH3+CO2+H2O=NH4HCO3
②NH4HCO3+NaCl=NaHCO3+NH4Cl
③2NaHCO3=Na2CO3+CO2↑+H2O
(三)候氏制碱法。低温下先向饱和食盐水中通入氨气,再通入二氧化碳可析出碳酸氢钠,再加入细盐末,因同离子效应,低温氯化铵溶解度突然降低,而食盐的溶解度变化不大,所以氯化铵析出而食盐不析出;再用氨饱和后通二氧化碳,结果往返析出NaHCO3和NH4Cl。该法生产的纯碱质量优良,纯白如雪。
(1)相比另外两种方法,布兰制碱法工艺的缺点除了成本较高,生成CO和CaS等污染物外还有__________________________和_____________________________(写两点)。
(2)氨碱法工艺的中循环利用的物质是_________(填化学式);产品的副产物NH4Cl既可以做氮肥又可以重新生成氨气。写出NH4Cl与生石灰反应的化学方程式 。
(3)候氏制碱法反应的方程式为____________________________________________。
(4)为什么候氏制碱法工艺中先向饱和食盐水中通入氨气,再通入二氧化碳。理由是__________________________________________________(写一点)。
(5)候氏制碱法产品纯碱中含有碳酸氢钠。如果用加热分解的方法测定纯碱中碳酸氢钠的质量分数,用m1表示加热前纯碱样品的质量,m2表示加热后固体的质量。则纯碱中碳酸氢钠的质量分数可表示为:___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
前苏联科学家欧巴林教授在其著作中曾说:“生命起源于甲烷”,英国科学家巴纳尔教授则认为生命是从二氧化碳及水开始的。与之相关的转化关系如下图所示(部分反应条件已略去)。
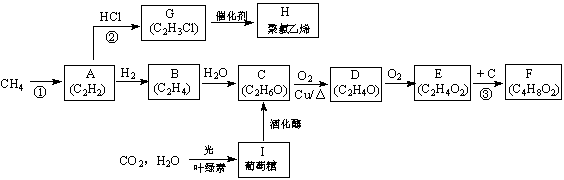 (1)C中官能团的电子式为 ▲ ;反应②的类型为 ▲ 。
(1)C中官能团的电子式为 ▲ ;反应②的类型为 ▲ 。
(2)写出结构简式:D为 ▲ ;H为 ▲ 。
(3)反应③的化学方程式为 ▲ ;二氧化碳及水光合作用生成葡萄糖的化学方程式为
▲ 。
(4)在自然界纤维素与水可在甲烷菌催化下水解生成甲烷和二氧化碳,写出该反应的化学方程式并配平: ▲ 。
(5)已知:断开1mol共价键吸收的能量或形成1mol共价键释放的能量数据如下表
| 共价键 | H—H | C—H | C≡C |
| 能量变化/kJ·mol-1 | 436 | 413 | 812 |
反应① 2CH4(g) →C2H2(g) +3H2(g) △H= ▲ kJ·mol-1。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com