
【题目】制作隐形眼镜的材料应该具有亲水性。聚甲基丙烯甲酯![]() 是制作隐形眼镜的材料之一。其合成路线如下:
是制作隐形眼镜的材料之一。其合成路线如下:

完成下列填空:
![]() 写出结构简式:E______;A的一种同分异构体,能与新制氢氧化铜反应______。
写出结构简式:E______;A的一种同分异构体,能与新制氢氧化铜反应______。
![]() 反应
反应![]() 的有机反应类型______。
的有机反应类型______。
![]() 反应
反应![]() 的试剂和反应条件______。
的试剂和反应条件______。
![]() 反应
反应![]() 的化学方程式______。
的化学方程式______。
![]() 聚甲基丙烯酸羟乙酯
聚甲基丙烯酸羟乙酯![]() 也可制作隐形眼镜
也可制作隐形眼镜![]() 结构简式见图
结构简式见图![]() ,用
,用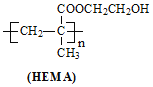 制作的隐形眼镜比PMMA制作的亲水性好,原因是______。
制作的隐形眼镜比PMMA制作的亲水性好,原因是______。
![]() 佩戴隐形眼镜最好常滴“人工眼泪”以滋润眼球。有一种“人工眼泪”成分是聚乙烯醇
佩戴隐形眼镜最好常滴“人工眼泪”以滋润眼球。有一种“人工眼泪”成分是聚乙烯醇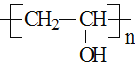
![]() 已知乙烯醇
已知乙烯醇![]() 不稳定,写出以乙炔为原料
不稳定,写出以乙炔为原料![]() 其他无机原料任选
其他无机原料任选![]() 制取聚乙烯醇的合成路线___________________。
制取聚乙烯醇的合成路线___________________。![]() 合成路线常用的表示方式为:
合成路线常用的表示方式为:![]() 目标产物
目标产物![]()
【答案】![]()
![]() 加成反应 浓硫酸、加热
加成反应 浓硫酸、加热  +CH3OH
+CH3OH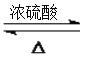
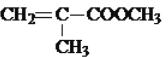 +H2O HEMA分子中含有羟基,具有极性,可以吸引水分子
+H2O HEMA分子中含有羟基,具有极性,可以吸引水分子 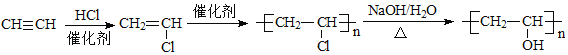
【解析】
(1)-(5)A发生加成反应生成B ,B 发生水解反应生成C,E发生加聚反应生成PMMA,则E为![]() ,D和甲醇发生酯化反应生成E,则D为CH2=C(CH3)COOH,所以C发生消去反应生成D。
,D和甲醇发生酯化反应生成E,则D为CH2=C(CH3)COOH,所以C发生消去反应生成D。
(6)以乙炔为原料制取聚乙烯醇,乙炔和氯化氢发生加成反应生成氯乙烯,氯乙烯发生加聚反应生成聚氯乙烯,聚氯乙烯发生水解反应生成聚乙烯醇。
![]() 通过以上分析知,E为
通过以上分析知,E为![]() ;A为丙酮,其一种同分异构体能与新制氢氧化铜反应,说明其同分异构体中含有醛基,结构简式为
;A为丙酮,其一种同分异构体能与新制氢氧化铜反应,说明其同分异构体中含有醛基,结构简式为![]() ,
,
故答案为:![]() ;
;![]() ;
;
![]() 根据流程可知,碳碳双键变为碳碳单键,反应
根据流程可知,碳碳双键变为碳碳单键,反应![]() 的有机反应类型加成反应,故答案为:加成反应;
的有机反应类型加成反应,故答案为:加成反应;
![]() 反应
反应![]() 为醇的消去反应生成碳碳双键,则该反应的试剂和反应条件浓硫酸、加热,故答案为:浓硫酸、加热;
为醇的消去反应生成碳碳双键,则该反应的试剂和反应条件浓硫酸、加热,故答案为:浓硫酸、加热;
![]() 发生酯化反应生成E,反应
发生酯化反应生成E,反应![]() 的化学方程式:
的化学方程式: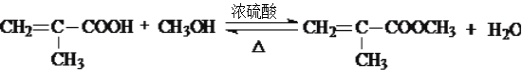 ;
;
故答案为: ;
;
![]() 分子中含有羟基,具有极性,可以吸引水分子所以用
分子中含有羟基,具有极性,可以吸引水分子所以用 制作的隐形眼镜比PMMA制作的亲水性好;
制作的隐形眼镜比PMMA制作的亲水性好;
故答案为:HEMA分子中含有羟基,具有极性,可以吸引水分子;
![]() 以乙炔为原料
以乙炔为原料![]() 其他无机原料任选
其他无机原料任选![]() 制取聚乙烯醇,乙炔和HCl发生加成反应生成氯乙烯,氯乙烯发生加聚反应生成聚氯乙烯,聚氯乙烯发生水解反应生成聚乙烯醇,其合成路线为
制取聚乙烯醇,乙炔和HCl发生加成反应生成氯乙烯,氯乙烯发生加聚反应生成聚氯乙烯,聚氯乙烯发生水解反应生成聚乙烯醇,其合成路线为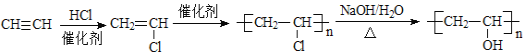 ,
,
故答案为: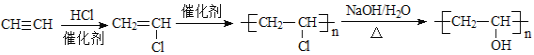 。
。


 暑假衔接培优教材浙江工商大学出版社系列答案
暑假衔接培优教材浙江工商大学出版社系列答案 欣语文化快乐暑假沈阳出版社系列答案
欣语文化快乐暑假沈阳出版社系列答案科目:高中化学 来源: 题型:
【题目】以废镍(含NiO,杂质为少量Fe2O3)生产Ni2O3的一种工艺流程如下:
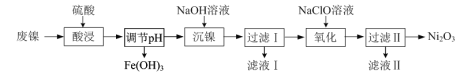
(1)“调节pH”后检验溶液中不再存在Fe3+的方法是______。
(2)“沉镍”的目的是将溶液中的Ni2+转化为Ni(OH)2沉淀,确认Ni2+已经完全沉淀的实验方法是______。
(3)“滤液Ⅱ”所含阴离子主要为Cl-,写出“氧化”时反应的离子方程式:______。
(4)若“氧化”反应不充分,所制Ni2O3样品中会混有Ni(OH)2。为测定样品中Ni2O3的质量分数,进行实验:称取5.000 g样品,加入足量硫酸后再加入100 mL 1.0 mol·L-1的Fe2+标准溶液,充分反应,加水定容至200 mL。取出20.00 mL,用0.040 mol·L-1 KMnO4标准溶液滴定,用去KMnO4标准溶液20.00 mL,试通过计算确定Ni2O3的质量分数。测定过程中涉及反应如下:Ni2O3+Fe2++H+=Ni2++Fe3++H2O(未配平);Fe2++MnO4-+H+=Fe3++Mn2++H2O(未配平)______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,向一定体积0.1 mol/L的醋酸溶液中逐滴加入等浓度的NaOH溶液,溶液pOH[pOH=-lgc(OH-)]与pH的变化关系如图所示,则( )

A.N点处pH>pOH,则N点处所示溶液呈酸性
B.该温度下水的离子积Kw=1×10-2a
C.Q点所示溶液呈中性,则M、N、Q三点中只有Q点溶液中水的电离出的c(H+)与水的电离c(OH-)相等
D.M点所示溶液的导电能力强于Q
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外活动小组进行Fe(OH)3胶体的制备实验并检验其性质。
(1)若将饱和FeCl3溶液分别滴入下列物质中,能形成胶体的是________(填字母)。
A.冷水 B.沸水 C.NaOH浓溶液 D.NaCl浓溶液
(2)现有甲、乙、丙三名同学进行Fe(OH)3胶体的制备:
①甲同学的操作:取一小烧杯,加入25 mL蒸馏水加热至沸腾,向沸水中逐滴加入1~2 mL FeCl3饱和溶液,继续煮沸至混合液呈红褐色,停止加热。请评价该操作是否正确______。
②乙直接加热饱和FeCl3溶液,请评价是否正确______。
③丙向沸水中滴加饱和FeCl3溶液,为了使反应进行充分,煮沸10分钟,请评价是否正确________。
(3)写出制备Fe(OH)3胶体的化学方程式: ____________________。证明有Fe(OH)3胶体生成的实验操作是_____________________。该操作利用胶体的性质是________。
(4)Fe(OH)3胶体稳定存在的主要原因是____________________(填字母,下同)。
A.胶体粒子直径小于1nm B.胶体粒子带正电荷
C.胶体粒子作布朗运动 D.胶体粒子能透过滤纸
(5)Fe(OH)3胶体区别于FeCl3溶液最本质的特征是________。
A.Fe(OH)3胶体粒子的直径在1~100 nm之间
B.Fe(OH)3胶体具有丁达尔效应
C.Fe(OH)3胶体是均一的分散系
D.Fe(OH)3胶体的分散质能透过滤纸
(6)若取少量制得的胶体加入试管中,加入硫酸铵溶液,现象是_____________,这种现象称为胶体的________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列解释中,不正确的是![]()
A.水很稳定![]() 以上才会部分分解
以上才会部分分解![]() 是因为水中含有大量的氢键所致
是因为水中含有大量的氢键所致
B.由于NaCl晶体和CsCl晶体中正负离子半径比不相等,所以两晶体中离子的配位数不相等
C.碘易溶于四氯化碳,甲烷难溶于水都可用相似相溶原理解释
D.MgO的熔点比![]() 高主要是因为MgO的晶格能比
高主要是因为MgO的晶格能比![]() 大
大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素W、X、Y、Z的原子数依次增加,由这些元素组成的常见物质的转化关系如图所示,其中a、b、d、g为化合物,a为淡黄色固体,c是Z的单质,该单质能与沸水反应,且该单质可制造照明弹,f为固体单质。下列有关说法正确的是
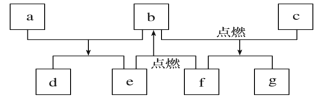
A.简单离子半径:Y>Z>X
B.元素的非金属性:W>X
C.X、Y两种元素组成的化合物只含离子键
D.最高价氧化物对应水化物的碱性:Y>Z
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学设计用下图的装置制备少量的AlCl3(易水解)。下列说法错误的是( )

A. B装置中所装试剂为饱和的NaCl溶液,其作用是除去氯气中的HCl
B. 装置C和F中的试剂均为浓硫酸,其作用是防止水蒸气进人E中
C. 用50mL12mol/L的盐酸与足量的MnO2反应,所得氯气可以制取26.7gAlCl3
D. 实验过程中应先点燃A处的酒精灯,待装置中充满黄绿色气体时再点燃D处的酒精灯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)汽车发动机工作时会引发N2和O2反应,其能量变化示意图如下:
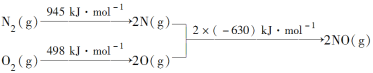
写出该反应的热化学方程式:____。
(2)科学家制造出一种使用固体电解质的燃料电池,其效率更高,可用于航空航天。如图1所示装置中,以稀土金属材料作惰性电极,在两极上分别通入CH4和空气,其中固体电解质是掺杂了Y2O3的ZrO2固体,它在高温下能传导正极生成的O2-(O2+4e-=2O2-)。
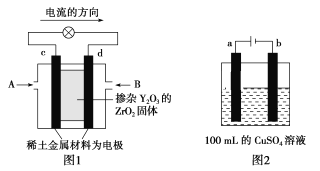
①c电极的名称为___,d电极上的电极反应式为____。
②如图2所示电解100mL0.5mol·L-1CuSO4溶液,a电极上的电极反应式为___。若要使电解质溶液恢复到电解前的状态,可加入___(填字母)。
a.CuO b.Cu(OH)2 c.CuCO3 d.Cu2(OH)2CO3
(3)利用反应2Cu+O2+2H2SO4=2CuSO4+2H2O可制备CuSO4,若将该反应设计为原电池,其正极电极反应式为____。
(4)人工肾脏可采用间接电化学方法除去代谢产物中的尿素[CO(NH2)2],原理如图。
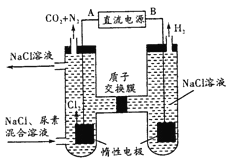
①电源的负极为____(填“A”或“B”)。
②阳极室中发生的反应依次为___。
③电解结束后,阴极室溶液的pH与电解前相比将___(填“增大”“减小”或“不变”);若两极共收集到气体13.44L(标准状况),则除去的尿素为___g(忽略气体的溶解)。
(5)化学镀的原理是利用化学反应生成金属单质沉积在镀件表面形成镀层。
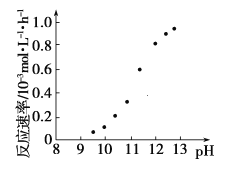
①若用铜盐进行化学镀铜,应选用____(填“氧化剂”或“还原剂”)与之反应。
②某化学镀铜的反应速率随镀液pH变化如图所示。该镀铜过程中,镀液pH控制在12.5左右。据图中信息,给出使反应停止的方法:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室将I2溶于KI溶液中,配制浓度较大的碘水,主要是因为发生了反应:I2(aq)+I-(aq)![]() I3- (aq),上述平衡体系中,I3-的物质的量浓度c(I3-)与温度T的关系如图所示(曲线上的任何一点都表示平衡状态),不正确的是( )
I3- (aq),上述平衡体系中,I3-的物质的量浓度c(I3-)与温度T的关系如图所示(曲线上的任何一点都表示平衡状态),不正确的是( )

A.该反应的正反应是吸热反应B.在反应进行到D点时,v正>v逆
C.A点与C点的化学反应速率vA<vCD.A点与B点相比,B点的c(I2)大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com