


 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案科目:高中化学 来源: 题型:
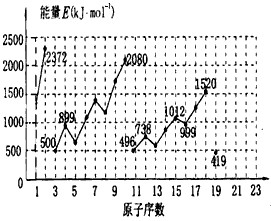
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 催化剂 |
| 时间/min | 0 | 2 | 4 | 6 | 8 | 10 |
| c(CO2)(mol?L-1) | 1 | 0.85 | 0.5 | 0.5 | 0.6 | 0.6 |
| c(H2)(mol?L-1) | 1 | 0.85 | 0.5 | 0.5 | 0.6 | 0.6 |
| c(CO)(mol?L-1) | 0 | 0.15 | 0.5 | 0.5 | 0.9 | 0.9 |
| c(H2O)(mol?L-1) | 0 | 0.15 | 0.5 | 0.5 | 0.4 | 0.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
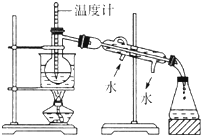 某化学课外小组以海带为原料制取少量碘水,现用CCl4 从碘水中萃取碘并用分液漏斗分离两种溶液.其实验可分解为如下各步:
某化学课外小组以海带为原料制取少量碘水,现用CCl4 从碘水中萃取碘并用分液漏斗分离两种溶液.其实验可分解为如下各步:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com