
| A、SO2、SiO2、CO2、CO均为酸性氧化物 |
| B、稀豆浆、硅酸、水玻璃、氯化铁溶液均为胶体 |
| C、烧碱、冰醋酸、四氯化碳、NH3均为电解质 |
| D、BaSO4的水溶液不导电,但BaSO4是强电解质 |


 53随堂测系列答案
53随堂测系列答案科目:高中化学 来源: 题型:
| A、元素周期表中的第ⅠA族元素全部是碱金属元素 |
| B、元素周期表中的第ⅦA族元素全部是非金属元素 |
| C、元素周期表中的0族元素最外层电子数都是8个 |
| D、元素周期表划分为7个周期18个族 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
| A、H2的燃烧热为-241.8kJ |
| B、2H2(g)+O2(g)=2H2O(g);△H=-483.6kJ/mol |
| C、1molH2完全燃烧生成液态水放出的热量大于241.8kJ |
| D、断开1molH2O的化学键吸收的总能量大于断裂1molH2和0.5 molO2的化学键所吸收的总能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、25mL 3 mol?L-1的KCl |
| B、75 mL 1.5 mol?L-1的CaCl2 |
| C、150 mL 1 mol?L-1的NaCl |
| D、100 mL 2 mol?L-1的FeCl3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 编号 | 1 | 2 | 3 |
| 混合物质量/g | 4.36 | 5.54 | 9.81 |
| 硫酸溶液体积/mL | 50.00 | 50.00 | 50.00 |
| 生成SO2的物质的量/mol | 0.03 | 0.0375 | 0.03 |
查看答案和解析>>
科目:高中化学 来源: 题型:
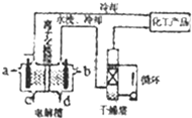 工业上电解饱和食盐水能制取多种化工原料,其设备示意图如图:
工业上电解饱和食盐水能制取多种化工原料,其设备示意图如图: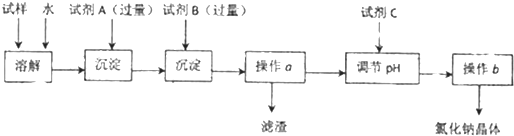
| ||
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com