
| A. | KClO3是氧化剂 | |
| B. | 被氧化与被还原的氯元素的质量比为5:1 | |
| C. | H2SO4既不是氧化剂又不是还原剂 | |
| D. | 1 mol KClO3参加反应时有10 mol电子转移 |
分析 5KCl+KClO3+3H2SO4═3Cl2↑+3K2SO4+3H2O中,Cl元素的化合价由-1价升高为0,Cl元素的化合价由+5价降低为0,该反应转移5e-,以此解答.
解答 解:5KCl+KClO3+3H2SO4=3Cl2↑+3K2SO4+3H2O中,KCl中Cl元素由-1价升高到0,KClO3中Cl元素由+5价降低为0,
A.含元素化合价降低的物质为氧化剂,则KClO3是氧化剂,故A正确;
B.KCl为还原剂,被氧化,KClO3是氧化剂被还原,由反应可知被氧化与被还原的氯元素的质量比为5:1,故B正确;
C.反应中只有Cl元素化合价发生变化,H2SO4中没有元素化合价的变化,则 H2SO4既不是氧化剂又不是还原剂,故C正确;
D.1molKClO3参加反应时有1mol×(5-0)=5mol电子转移,故D错误;
故选D.
点评 本题考查氧化还原反应,把握反应中元素的化合价变化为解答的关键,侧重氧化还原反应基本概念和转移电子的考查,题目难度不大.


 字词句段篇系列答案
字词句段篇系列答案科目:高中化学 来源: 题型:选择题
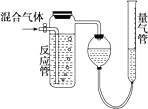 测量SO2、N2、O2混合气体中SO2含量的装置如图,反应管中装有碘的淀粉溶液.SO2和I2发生的反应为(N2、O2不与I2反应):SO2+I2+2H2O═H2SO4+2HI.反应管内溶液蓝色消失后,没有及时停止通气.测得的SO2的体积分数( )
测量SO2、N2、O2混合气体中SO2含量的装置如图,反应管中装有碘的淀粉溶液.SO2和I2发生的反应为(N2、O2不与I2反应):SO2+I2+2H2O═H2SO4+2HI.反应管内溶液蓝色消失后,没有及时停止通气.测得的SO2的体积分数( )| A. | 偏高 | B. | 偏低 | C. | 无影响 | D. | 无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol/LNaHCO3溶液与0.1mol/LNaOH溶液等体积混合,所得溶液中:c(Na+)>c(CO32-)>c(HCO3-)>c(OH-) | |
| B. | pH相同的①CH3COONa②NaHCO3③NaAlO2三份溶液中的c(Na+):②>③>① | |
| C. | 0.1mol•L-1的硫化钠溶液中:c(OH-)=c(H+)+c(HS-)+c(H2S) | |
| D. | 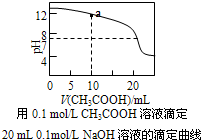 图中a点溶液中各离子浓度的关系是:c(OH-)=c(H+)+c(CH3COO-)+2c(CH3COOH) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氮化铝(AIN)是一种新型的无机材料,广泛应用于集成电路生产领域.氮化铝产品中往往含有炭和氧化铝杂质.化学研究性学习小组为测定该产品中氮化铝的质量分数,取一定量的氮化铝产品,进行以下实验.已知:
氮化铝(AIN)是一种新型的无机材料,广泛应用于集成电路生产领域.氮化铝产品中往往含有炭和氧化铝杂质.化学研究性学习小组为测定该产品中氮化铝的质量分数,取一定量的氮化铝产品,进行以下实验.已知:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 所含质子数=A-n | B. | 所含中子数=A-Z | C. | 所含电子数=Z+n | D. | 质量数=Z+A |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 灼热的碳和二氧化碳的反应 | B. | Ba (OH)2•8H2O晶体和NH4Cl晶体混合 | ||
| C. | 生石灰和水反应 | D. | CaCO3分解 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用新制氢氧化铜悬浊液能鉴别葡萄糖、甘油、乙醛、乙酸 | |
| B. | 用酸性高锰酸钾即可检验CH2=CHCHO中的碳碳双键 | |
| C. | 为检验氯乙烷中的氯元素,在水解液中滴加稀硫酸酸化,再滴入AgNO3溶液,产生白色沉淀 | |
| D. | 用溴水即可鉴别溴苯、苯、己烯与苯酚 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该晶体属于原子晶体,其化学键比金刚石更牢固 | |
| B. | 该晶体中每个碳原子连接4个氮原子、每个氮原子连接3个碳原子 | |
| C. | 该晶体中碳原子和氮原子的最外层都满足8电子结构 | |
| D. | 该晶体与金刚石相似,原子间都是非极性键 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com