
I����1��CH3OH��1����H2��ȼ���ȷֱ�Ϊ��725.5 kJ/mol��285.8 kJ/mol��д����ҵ����CO2��H2�ϳ�CH3OH��1�����Ȼ�ѧ����ʽ�� ��
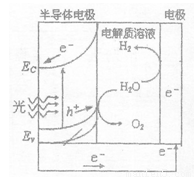
��2����ͼΪ����ˮ��װ�ã�д������ʱ�뵼��缫���淢���ĵ缫��Ӧʽ________��ĿǰӦ�����İ뵼�������Si����������������ǡ�21���͵���Դ���������Ϊ����Դ��ԭ����ܵ��� ������ĸ����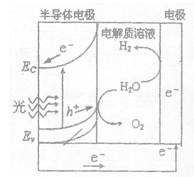
a������Ȼ���д��ڴ����ĵ��ʹ�
b�������ͨ����ѧ������������
c������н�ǿ�������ԣ�ȼ�շų���������
d����Ļ�ѧ���ʲ����ã����ڰ�ȫ���桢����
II����0.2mol/L HA��Һ��O��lmol/L NaOH��Һ�������ϣ���û����Һc��Na+��>c��A������
�á�>������<����=����д���пհף�
��1�������Һ��c��A����____c��HA����c��HA��+c��A����__0.lmol/L��
��2�������Һ�У���ˮ���������c��OH���� 0.2mol/L HA��Һ����ˮ�������c��H+��
��3��25��ʱ�����ȡ0.2mol/L HB��Һ��0.lmol/L NaOH��Һ�������ϣ���û����Һ��pH <7����HB�ĵ���̶� NaB��ˮ��̶ȡ�

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
| c(CH3OH) |
| c(CO)��c2(H2) |
| c(CH3OH) |
| c(CO)��c2(H2) |
| b-a-4c |
| 2 |
| b-a-4c |
| 2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
| V2 |
| a2 |
| V2 |
| a2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2010-2011ѧ�������и���5���¿������ۣ���ѧ���� ���ͣ������
I����1��CH3OH��1����H2��ȼ���ȷֱ�Ϊ��725.5 kJ/mol��285.8 kJ/mol��д����ҵ����CO2��H2�ϳ�CH3OH��1�����Ȼ�ѧ����ʽ�� ��
��2����ͼΪ����ˮ��װ�ã�д������ʱ�뵼��缫���淢���ĵ缫��Ӧʽ________��ĿǰӦ�����İ뵼�������Si����������������ǡ�21���͵���Դ���������Ϊ����Դ��ԭ����ܵ��� ������ĸ����
a������Ȼ���д��ڴ����ĵ��ʹ�
b�������ͨ����ѧ������������
c������н�ǿ�������ԣ�ȼ�շų���������
d����Ļ�ѧ���ʲ����ã����ڰ�ȫ���桢����
II����0.2mol/L HA��Һ��O��lmol/L NaOH��Һ�������ϣ���û����Һc��Na+��>c��A������
�á�>������<����=����д���пհף�
��1�������Һ��c��A����____c��HA����c��HA��+c��A����__0.lmol/L��
��2�������Һ�У���ˮ���������c��OH���� 0.2mol/L HA��Һ����ˮ�������c��H+��
��3��25��ʱ�����ȡ0.2mol/L HB��Һ��0.lmol/L NaOH��Һ�������ϣ���û����Һ��pH <7����HB�ĵ���̶� NaB��ˮ��̶ȡ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
I����1��CH3OH��1����H2��ȼ���ȷֱ�Ϊ��725.5 kJ/mol��285.8 kJ/mol��д����ҵ����CO2��H2�ϳ�CH3OH��1�����Ȼ�ѧ����ʽ�� ��
��2����ͼΪ����ˮ��װ�ã�д������ʱ�뵼��缫���淢���ĵ缫��Ӧʽ________��ĿǰӦ�����İ뵼�������Si����������������ǡ�21���͵���Դ���������Ϊ����Դ��ԭ����ܵ��� ������ĸ����
a������Ȼ���д��ڴ����ĵ��ʹ�
b�������ͨ����ѧ������������
c������н�ǿ�������ԣ�ȼ�շų���������
d����Ļ�ѧ���ʲ����ã����ڰ�ȫ���桢����
II����0.2mol/L HA��Һ��O��lmol/L NaOH��Һ�������ϣ���û����Һc��Na+��>c��A������
�á�>������<����=����д���пհף�
��1�������Һ��c��A����____c��HA����c��HA��+c��A����__0.lmol/L��
��2�������Һ�У���ˮ���������c��OH���� 0.2mol/L HA��Һ����ˮ�������c��H+��
��3��25��ʱ�����ȡ0.2mol/L HB��Һ��0.lmol/L NaOH��Һ�������ϣ���û����Һ��pH <7����HB�ĵ���̶� NaB��ˮ��̶ȡ�
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com