
| A、1molNa2O2晶体中含有的离子总数为4NA |
| B、常温下,100mLlm/LNa2CO3溶液中阴离子总数大于0.1NA |
| C、假设1mol氯化铁完全转化为氢氧化铁胶体,则分散系中胶粒微粒数为NA |
| D、标准状况下,0.1molCl2溶于水,转移的电子数为0.1NA |


 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案 本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
本土教辅赢在暑假高效假期总复习云南科技出版社系列答案 暑假作业北京艺术与科学电子出版社系列答案
暑假作业北京艺术与科学电子出版社系列答案 第三学期赢在暑假系列答案
第三学期赢在暑假系列答案科目:高中化学 来源: 题型:
| A、盐酸中放出的H2最多 |
| B、硫酸中放出的H2最多 |
| C、醋酸中放出的H2最多 |
| D、三种酸中产生的H2一样多 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、增加6.4 g |
| B、减轻6.4 g |
| C、增加2.16 g |
| D、减轻2.16 g |
查看答案和解析>>
科目:高中化学 来源: 题型:
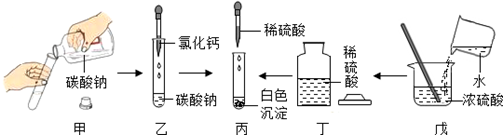
| A、甲中试剂瓶标签正对手心,是为了防止手被腐蚀 |
| B、乙中将滴管伸入试管内,是为了防止试剂滴落到试管外 |
| C、丁中试剂瓶盖倒放在桌面上,主要是为了避免瓶中试剂受污染 |
| D、戊中将水缓慢倒入浓硫酸并搅拌,是为了防止局部过热引起酸液飞溅 |
查看答案和解析>>
科目:高中化学 来源: 题型:
+ 5 |
| A、H2与H3互为同位素 | ||
B、N
| ||
| C、C60的硬度比金刚石大 | ||
| D、O2与O4互为同素异形体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
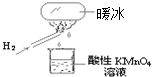 “暖冰”是韩国首尔大学科学家将水置于一个足够强的电场中,在20℃时,水分子瞬间凝固形成的.某老师在课堂上做了一个如图所示的实验,发现烧杯中酸性KMnO4溶液褪色.若将烧杯中的溶液换成含有少量KSCN 的FeCl2溶液,则溶液呈血红色.则下列说法中不正确的是( )
“暖冰”是韩国首尔大学科学家将水置于一个足够强的电场中,在20℃时,水分子瞬间凝固形成的.某老师在课堂上做了一个如图所示的实验,发现烧杯中酸性KMnO4溶液褪色.若将烧杯中的溶液换成含有少量KSCN 的FeCl2溶液,则溶液呈血红色.则下列说法中不正确的是( )| A、在电场作用下,水分子间更易形成氢键,因而可以制得“暖冰” |
| B、水凝固形成20℃时的“暖冰”所发生的变化是化学变化 |
| C、该条件下H2燃烧生成了既具有氧化性又具有还原性的物质 |
| D、该条件下H2燃烧的产物中可能含有一定量的H2O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、2g重水(D2O,D为
| ||
| B、0.1mol F-中含有的电子数 | ||
| C、标准状况下11.2L N2和NO混合气体中的原子数 | ||
| D、1L 1mol/L Na2SO4溶液中Na+数 |
查看答案和解析>>
科目:高中化学 来源: 题型:
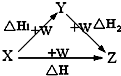 X、Y、Z、W有如图所示的转化关系,已知焓变:△H=△H1+△H2,则X、Y可能是( )
X、Y、Z、W有如图所示的转化关系,已知焓变:△H=△H1+△H2,则X、Y可能是( )| A、①②③④ | B、①③ |
| C、②④ | D、①②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、③②④①⑦ |
| B、③②⑤⑥④ |
| C、③②④⑤⑦ |
| D、②④①⑦⑤ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com