
| A. | pH=3的0.1mol•L-1的NaHC2O4溶液中:c(H+)=c(OH)+c(C2O42-) | |
| B. | 0.1mol•L-1的(NH4)2S溶液中:c(NH4+)=2c(S2-)+2c(HS-)+2c(H2S) | |
| C. | pH=4的CH3COOH溶液中:$\frac{c(C{H}_{3}CO{O}^{-})}{c(O{H}^{-})•c(C{H}_{3}COOH)}$<1 | |
| D. | 等物质的量浓度,等体积的NaF溶液和HF溶液混合所得稀溶液中:c(H+)+c(HF)<c(F- )+2c(OH-) |
分析 A、NaHC2O4溶液中存在物料守恒:c(Na+)=c(HC2O4-)+c(C2O42-)+c(H2C2O4),电荷守恒:c(H+)+c(Na+)=c(OH-)+2c(C2O42-)+c(HC2O4-),据此分析;
B、铵根离子水解产生一水合氨;
C、pH=4的CH3COOH溶液中,c(H+)=10-4mol/L,所以c(OH-)=10-10mol/L,醋酸是弱酸只有部分电离;
D、电荷守恒和物料守恒分析解答.
解答 解:A、NaHC2O4溶液中存在物料守恒:c(Na+)=c(HC2O4-)+c(C2O42-)+c(H2C2O4),电荷守恒:c(H+)+c(Na+)=c(OH-)+2c(C2O42-)+c(HC2O4-),电荷守恒-物料守恒得:c(H+)=c(OH-)+c(C2O42-)-c(H2C2O4),故A错误;
B、据物料守恒应为(NH4)2S溶液中:c(NH3•H2O)+c(NH4+)=2c(S2-)+2c(HS-)+2c(H2S),故B错误;
C、pH=4的CH3COOH溶液中,c(H+)=10-4mol/L,c(CH3COO-)约为10-4mol/L,c(OH-)=10-10mol/L,醋酸是弱酸只有部分电离c(CH3COOH)大于10-4mol/L,所以$\frac{c(C{H}_{3}CO{O}^{-})}{c(O{H}^{-})•c(C{H}_{3}COOH)}$>1,故C错误;
D、等物质的量浓度、等体积的NaF溶液和HF溶液混合所得的稀溶液中,根据电荷守恒得:c(H+)+c(Na+)=c(F-)+c(OH-),据物料守恒得:2c(Na+)=c(F-)+c(HF),电荷守恒×2-物料守恒得2c(H+)+c(HF)=c(F- )+2c(OH-),故D正确;
故选D.
点评 本题考查了离子浓度大小比较,根据溶液的酸碱性再结合电荷守恒、物料守恒来判断离子浓度大小,易错选项是A,根据电荷守恒结合物料守恒分析,为易错点.


科目:高中化学 来源: 题型:选择题
| A. | 钠和硫酸铜溶液反应:2Na+Cu2+═Cu2+2Na+ | |
| B. | 工业上将Cl2通入石灰乳中制漂白粉:Cl2+2OH-═Cl-+ClO-+H2O | |
| C. | 向Ba(OH)2溶液中加入少量的NH4HSO4溶液:Ba2++OH-+H++SO42-═BaSO4↓+H2O | |
| D. | 1.0mol/L的NaAlO2溶液和2.5mol/L的盐酸等体积混合2AlO2-+5H+═Al3++Al(OH)3↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
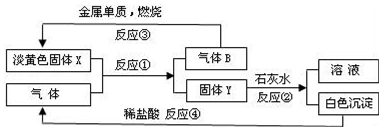
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 在自行车的钢圈表面镀镍 | B. | 在地下钢铁管道上连接铜块 | ||
| C. | 改变金属内部结构制成不锈钢 | D. | 健身器村刷油漆或包上一层塑料层 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | O2 和O3 | B. | ${\;}_6^{14}C$和${\;}_6^{12}C$ | ||
| C. | CH4 和CH3CH3 | D. | CH3CH2CH2CH3和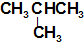 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 容器内气体的压强不变,反应一定处于平衡状态 | |
| B. | 降低 C(CO)和增加C (s),均可以使平衡向正反应方向移动 | |
| C. | 其它条件一定时,升高温度和减小压强均不利于提高CO2转化率 | |
| D. | 在一定条件下,CO2的生成速率等于C(s)的生成速率时,反应一定处于平衡状态 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属钠与水反应:Na+2H2O═Na++2OH-+H2↑ | |
| B. | 向AlCl3溶液中加入过量的NaOH溶液 Al3++3OH-═Al(OH)3↓ | |
| C. | Fe3O4与稀硝酸溶液反应:2Fe3O4+18H+═6Fe3++H2↑+8H2O | |
| D. | NaHSO4溶液与足量Ba(OH)2溶液混合:H++SO42-+Ba2++OH-═BaSO4↓+H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com