
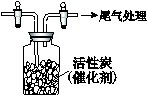
 MnCl2+Cl2↑+2H2O(2分);
MnCl2+Cl2↑+2H2O(2分); SO2Cl2
SO2Cl2 MnCl2+Cl2↑+2H2O;
MnCl2+Cl2↑+2H2O; SO2Cl2,由上面的分析可知反应后的混合气体中必然存在SO2和Cl2两种气体,若该反应不是可逆反应,则不可能2种反应物同时有剩余,所以SO2和Cl2生成SO2Cl2的反应为可逆反应。
SO2Cl2,由上面的分析可知反应后的混合气体中必然存在SO2和Cl2两种气体,若该反应不是可逆反应,则不可能2种反应物同时有剩余,所以SO2和Cl2生成SO2Cl2的反应为可逆反应。

科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
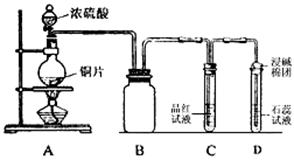
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
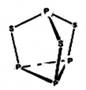
| A.该物质中磷元素的化合价为+3 |
B.该物质分子中含有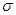 键和 键和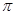 键 键 |
| C.该物质的熔、沸点比食盐高 |
| D.该物质22g含硫原子的数目约为1.806×1023 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.铜和稀硝酸制一氧化氮 | B.氯化钠与浓硫酸制氯化氢 |
| C.锌和稀硫酸制氢气 | D.硫化亚铁与稀硫酸制硫化氢 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
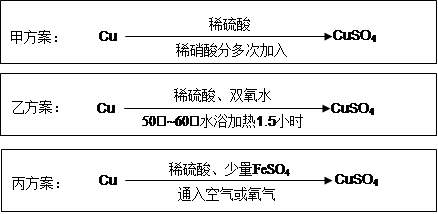
| A.CaO | B.NaOH | C.CuCO3 | D.Cu2(OH)2CO3 E.Fe2(SO4)3 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 CO2(g) ?H=-283.0 kJ/mol
CO2(g) ?H=-283.0 kJ/mol SO2(g) ?H=-296.0 kJ/mol
SO2(g) ?H=-296.0 kJ/mol| A.两个反应均为氧化还原反应 |
| B.CO2与SO2可以用澄清石灰水鉴别 |
| C.CO2分子中各原子最外层均为8电子稳定结构 |
D.相同条件下:2CO(g)+SO2(g)  S(g)+2CO2 (g)?H=-270kJ/mol S(g)+2CO2 (g)?H=-270kJ/mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com