
| A. | 苹果是酸性食物 | B. | 梨、桃是碱性食物 | ||
| C. | 猪肉、牛肉是碱性食物 | D. | 巧克力、奶油是碱性食物 |
分析 酸性食物:含硫、磷、氯等矿物质较多的食物,在体内的最终代谢产物常呈酸性,如肉、蛋鱼等动物食品及豆类和谷类等.
碱性食物:含钾、钠、钙、镁等矿物质较多的食物,在体内的最终的代谢产物常呈碱性,如,蔬菜、水果、乳类、大豆和菌类等.
解答 解:A.苹果属于水果,在体内的最终的代谢产物常呈碱性,属于碱性食物,故A错误;
B.梨、桃属于水果,在体内的最终的代谢产物常呈碱性,属于碱性食物,故B正确;
C.猪肉、牛肉富含蛋白质,在体内的最终代谢产物常含氮,属于酸性食物,故C错误;
D.巧克力、奶油富含脂肪,在体内的最终代谢产物常呈酸性,属于酸性食物,故D错误.
故选B.
点评 本题考查了食物的酸碱性,难度不大,判断食物的酸碱性,并非根据人们的味觉、也不是根据食物溶于水中的化学性,而是根据食物进入人体后所生成的最终代谢物的酸碱性而定.


科目:高中化学 来源: 题型:选择题
| A. | $\frac{a+b}{5×100%}$ | B. | $\frac{2(a+b)}{5b×100%}$ | C. | $\frac{200(a+b)}{5b}$% | D. | $\frac{(a+b)}{5a×100%}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 合成纤维和光导纤维都属于新型无机非金属材料 | |
| B. | “地沟油”禁止食用,但经过加T处理后,可以用来制取肥皂和生物柴油 | |
| C. | 大力推广应用“脱硫、脱硝”技术,可减少硫氧化物、氮氧化物对空气的污染 | |
| D. | 利用丁达尔效应鉴别 Fe(OH)3胶体和FeCl3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 早晨的树林里会看到太阳透过树叶射出的美丽光束 | |
| B. | 浑浊的水可以用明矾净化 | |
| C. | 向FeCl3溶液中加入NaOH溶液,会出现红褐色沉淀 | |
| D. | 尿毒症患者做“血液透析” |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入苯酚显紫色的溶液:K+、NH4+、Cl-、I-;加入酚酞呈红色的溶液:SO42-、K+、Cl-、HSO3-分别都不能大量共存(常温下) | |
| B. | $\frac{c({H}^{+})}{c(O{H}^{-})}$=1×10-12的溶液:K+、AlO2-、CO32-、Na+; pH=2的溶液:NO3-、Fe2+、Na+、Al3+分别都可以大量共存(常温下) | |
| C. | 已知:25℃时,Mg(OH)2的Ksp=5.61×10-12,MgF2的KSP=7.42×10-11,25℃时,在Mg(OH)2的悬浊液中加入NaF溶液后,Mg(OH)2 可以转化为MgF2 | |
| D. | 表示H2燃烧热的化学方程式为:H2(g)+$\frac{1}{2}$O2(g)═H2O(1);△H=-285.8kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
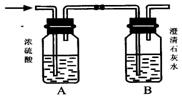 某混合气体X含H2、CO、CH4中的一种或几种组成.将X气体燃烧,把燃烧后生成的气体通过A、B两个洗气瓶.试回答下列问题:
某混合气体X含H2、CO、CH4中的一种或几种组成.将X气体燃烧,把燃烧后生成的气体通过A、B两个洗气瓶.试回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
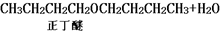
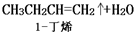
| 化合物 | 密度(g•cm-3) | 水溶性 | 沸点(℃) |
| 冰乙酸 | 1.05 | 易溶 | 118.1 |
| 正丁醇 | 0.80 | 微溶 | 117.2 |
| 正丁醚 | 0.77 | 不溶 | 142.0 |
| 乙酸正丁酯 | 0.90 | 微溶 | 126.5 |
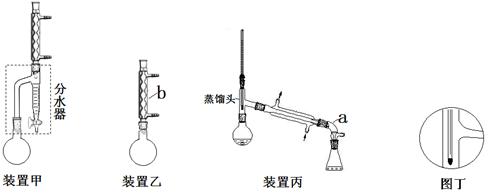


查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com