
【题目】在一定条件下,xA+yB![]() zC的反应达到平衡。
zC的反应达到平衡。
(1)已知A、B、C都是气体,在减压后平衡向逆反应方向移动,则x、y、z之间的关系是__________________;
(2)已知C是气体,且x+y=z,在增大压强时,如果平衡发生移动,则平衡一定向_____________移动;
(3)已知B、C是气体,当其他条件不变,增大A的物质的量时,平衡不发生移动,则A是_____________态物质。
(4)若加热后C的质量分数减少,则正反应是_________(填“放热”或“吸热”)反应。
科目:高中化学 来源: 题型:
【题目】如图①、②、③、④、⑤五组仪器(可重复使用),选择合适的装置和药品能完成的实验是( )
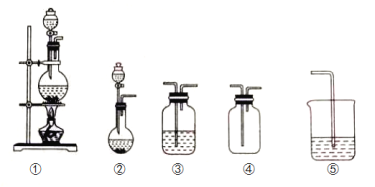
选项 | 实验目的 | 实验装置 | 实验药品 |
A | 制备并收集HCl气体 | ①③④ | 浓盐酸、浓硫酸、水 |
B | 比较氯气和溴的氧化性强弱 | ①③③⑤ | MnO2、浓盐酸、饱和食盐水、溴化钾溶液、氢氧化钠溶液 |
C | 探究乙烯的加成反应 | ①③ | 无水乙醇、浓硫酸、溴的四氯化碳溶液 |
D | 探究二氧化硫的还原性 | ②③③ | 亚硫酸钠、30%的硝酸、溴水、氢氧化钠溶液 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】认真分析物质的量浓度的概念及其定义式并思考,下列溶液中溶质的物质的量浓度为1mol·L-1的是( )
A. 将40gNaOH溶解于1L水中
B. 将22.4L氯化氢气体溶于水配成1L溶液
C. 将1L10 mol·L-1的浓盐酸与9L水混合
D. 将10gNaOH溶解于水中配成250mL溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮元素是一种重要的非金属元素,可形成多种化合物。试回答下列有关问题:
(1)①已知4CO(g)+2NO2(g) ![]() 4CO2(g)+N2(g) ΔH=-1 200 kJ·mol-1对于该反应,改变某一反应条件,(已知温度T2>T1)下列图像正确的是_______(填代号)
4CO2(g)+N2(g) ΔH=-1 200 kJ·mol-1对于该反应,改变某一反应条件,(已知温度T2>T1)下列图像正确的是_______(填代号)

②已知CO与H2O在一定条件下可以发生反应:CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH= - Q kJ·mol-1 ,820 ℃时在甲、乙两个恒容密闭容器中,起始时按照下表进行投料,经过一段时间后达到平衡状态,若甲中CO的转化率为40%,则该反应的平衡常数为____________;乙容器吸收的热量为________________。
CO2(g)+H2(g) ΔH= - Q kJ·mol-1 ,820 ℃时在甲、乙两个恒容密闭容器中,起始时按照下表进行投料,经过一段时间后达到平衡状态,若甲中CO的转化率为40%,则该反应的平衡常数为____________;乙容器吸收的热量为________________。
![]()
(2)肼可作为火箭发动机的燃料,与氧化剂N2O4反应生成N2和水蒸气,已知:
① N2 (g) +2O2 (g) = N2O4 (l) ΔH =-19.5 kJ·mol-1
② N2H4(l)+O2(g) = N2(g) +2H2O(g) ΔH =-534.2 kJ·mol-1
写出肼与四氧化二氮反应的热化学方式______________。
(3)纯的叠氮酸(HN3)是无色液体,常用做引爆剂,常温下向25 mL 0.1mol·L-1 NaOH溶液中加入0. 2mol·L-1 HN3的溶液,滴加过程中的pH值的变化曲线(溶液混合时的体积变化忽略不计)如图。

①根据图像写出HN3的电离方程式:_________。
②下列说法正确的是_________________(填序号)
A.若用已知浓度的NaOH溶液滴定HN3溶液来测定HN3的浓度时应用甲基橙作指示剂
B.常温下,向0.2 mol·L-1 HN3的溶液中加水稀释,则![]() 不变
不变
C.分别中和pH均为4的HN3溶液和HCl溶液,消耗0.1 mol·L-1 NaOH溶液的体积相同
D.D点时溶液中离子浓度存在如下关系:2c(H+) + c(HN3) =c(N3-) + 2c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酰氯(SO2Cl2)是一种重要的化工试剂,实验室合成硫酰氯的实验装置如下图所示:

已知:① SO2(g) + Cl2(g)![]() SO2Cl2(l) △H = -97.3 kJ/mol;
SO2Cl2(l) △H = -97.3 kJ/mol;
② 硫酰氯通常条件下为无色液体,熔点为-54.1℃,沸点为69.1℃,在潮湿空气中“发烟”;100℃以上开始分解,生成二氧化硫和氯气,长期放置也会发生分解。
回答下列问题:
(1)装置甲为储气装置,用于提供氯气,则仪器A中盛放的试剂为______________。装置丙中活性炭的作用是______________。
(2)在上图方框内画出所缺装置,并注明相关试剂的名称。
(3)氯磺酸(ClSO3H)加热分解,也能制得硫酰氯与另外一种物质,该反应的化学方程式为_____________,分离产物的方法是(填字母)_________。
A.重结晶 B.过滤 C.蒸馏 D.萃取
(4)为提高本实验中硫酰氯的产率,在实验操作中需要注意的事项有________(填序号)。
① 先通冷凝水,再通气 ② 控制气流速率,宜慢不宜快
③ 若三颈烧瓶发烫,可适当降温 ④ 加热三颈烧瓶
(5)在无活性炭存在的条件下SO2与Cl2也可发生反应,现将SO2、Cl2按照一定比例通入水中,请设计 一个简单实验验证二者是否恰好完全反应: (简要描述实验步骤、现象和结论)。
仪器自选,供选择试剂:滴加酚酞的氢氧化钠溶液、碘化钾溶液、淀粉溶液、品红溶液。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度T1时,Ag2SO4在水中的沉淀溶解曲线如图实线所示。下列说法正确的是( )

A. T1时,Ag2SO4的溶度积常数(Ksp)为1×10-3
B. T1时,0.02 mol/L的AgNO3溶液与0.2 mol/L的Na2SO4溶液等体积混合不会生成沉淀
C. b点表示T1时Ag2SO4的饱和溶液,稀释时可以使溶液由b点变到a点
D. 仅通过降温的方法,可以使T2时的饱和溶液从c点变到T1时b点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符的是

A. 图1表示相同温度下,pH=1的盐酸和醋酸溶液分别加水稀释时pH的变化曲线,其中曲线Ⅱ为盐酸,且b点溶液的导电性比a点强
B. 图2中仅升高温度,纯水就可以从a点变到c点
C. 图2中在b点对应温度下,将pH=2的H2SO4与pH=10的NaOH溶液等体积混合后,溶液显中性
D. 图3 表示H2与O2反应过程中的能量变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ:蒸馏是实验室制备蒸馏水的常用方法,如图所示两个装置都可以制取蒸馏水。

(1)图Ⅰ是实验室制取蒸馏水的常用装置,仪器A、B的名称分别是:A___________、B___________;
(2)温度计水银球应置于_______________________________________;
(3)实验时A 中除加入一定量的自来水外,还需加入少量_____________,其作用是 __________________________;
(4)图Ⅱ装置也可用于少量蒸馏水的制取(加热及固定仪器略),其原理与图I完全相同,该装置中使用的玻璃导管较长,其作用是__________________。
Ⅱ:现用质量分数为98℅、密度为1.84g/mL的浓硫酸来配制480mL 0.2mol/L 的稀硫酸。可供选择的仪器有:①玻璃棒 ②烧瓶 ③烧杯 ④胶头滴管 ⑤量筒 ⑥容量瓶 ⑦托盘天平 ⑧药匙。完成下列问题:
(5)上述仪器中,在配制稀硫酸时不需要用到的是_____________(填序号);
(6)配制过程中需选用的容量瓶规格为_____________mL,经过计算,需要浓硫酸的体积为_______________;
(7)在配制过程中,能使所配溶液浓度偏高的是____________(填序号)
①洗涤量取浓硫酸后的量筒,并将洗涤液转移至容量瓶中
②为防止变质,稀释后的硫酸溶液应立即就转移到容量瓶中
③将浓硫酸直接倒入烧杯,再向烧杯中注入蒸馏水来稀释浓硫酸
④移液前,容量瓶中含有少量蒸馏水
⑤量取浓硫酸时,俯视刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酸乙酯是一种用途广泛的精细化工产品。工业生产乙酸乙酯的方法很多,如图:

下列说法正确的是
A. 反应①、②均是取代反应
B. 反应③、④的原子利用率均为100%
C. 与乙酸乙酯互为同分异构体的酯类化合物有2种
D. 乙醇、乙酸、乙酸乙酯三种无色液体可用Na2CO3溶液鉴别
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com