
【题目】中学化学中几种常见物质的转化关系如图所示(已知A为单质):将D溶液滴入沸水中可得到以F为分散质的红褐色胶体。请回答下列问题:

(1)红褐色胶体中F粒子直径大小的范围:___________________。
(2)写出A、B、H的化学式_____________、________、_________。
(3)①H2O2分子的电子式为_____________________。
②写出C的酸性溶液与双氧水反应的离子方程式:___________。
(4)鉴定E中阳离子时,可先加入_________溶液,再加热使之产生气体。
(5)在C溶液中加入与C等物质的量的Na2O2,恰好使C转化为F,写出该反应的离子方程式:_____。
【答案】 1~100nm Fe FeS H2SO4(稀) ![]() 2Fe2++H2O2+2H+=2Fe3++2H2O NaOH溶液 4Fe2++4Na2O2+6H2O=4Fe(OH)3↓+O2↑+8Na+
2Fe2++H2O2+2H+=2Fe3++2H2O NaOH溶液 4Fe2++4Na2O2+6H2O=4Fe(OH)3↓+O2↑+8Na+
【解析】将D溶液滴入沸水中可得到以F为分散质的红褐色胶体,则D中含有铁离子、F是Fe(OH)3,C和双氧水反应生成D,则C中含有亚铁离子,A能和S反应,A也能和稀硫酸反应生成亚铁盐,则A是Fe,C是FeSO4,D是Fe2(SO4)3,B是FeS,硫酸铁和氨水反应生成氢氧化铁和硫酸铵,则E是(NH4)2SO4;硫酸亚铁和过氧化钠反应生成氢氧化铁。则
(1)胶体微粒直径在1~100nm之间;(2)通过以上分析知,A、B、H分别是Fe、FeS、H2SO4(稀);(3)①双氧水是共价化合物,电子式为![]() ;②C是硫酸亚铁,硫酸亚铁和双氧水发生氧化还原反应生成硫酸铁和水,离子方程式为2Fe2++H2O2+2H+=2Fe3++2H2O;(4)E中有铵根离子,可取少量E于试管中,用胶头滴管加入氢氧化钠溶液,加热试管,可观察到试管口处湿润的红色石蕊试纸变蓝,说明有铵根离子;(5)硫酸亚铁和过氧化钠发生氧化还原反应生成氢氧化铁和氧气、硫酸钠,离子方程式为4Fe2++4Na2O2+6H2O=4Fe(OH)3↓+O2↑+8Na+。
;②C是硫酸亚铁,硫酸亚铁和双氧水发生氧化还原反应生成硫酸铁和水,离子方程式为2Fe2++H2O2+2H+=2Fe3++2H2O;(4)E中有铵根离子,可取少量E于试管中,用胶头滴管加入氢氧化钠溶液,加热试管,可观察到试管口处湿润的红色石蕊试纸变蓝,说明有铵根离子;(5)硫酸亚铁和过氧化钠发生氧化还原反应生成氢氧化铁和氧气、硫酸钠,离子方程式为4Fe2++4Na2O2+6H2O=4Fe(OH)3↓+O2↑+8Na+。


科目:高中化学 来源: 题型:
【题目】某同学按图所示的装置进行电解实验。下列说法正确的是( )
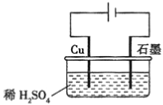
A. 电解过程中,铜极上有H2生成
B. 电解初期,主反应方程式为:2H2O=H2↑+O2↑
C. 整个电解过程中,H+的浓度不断增大
D. 电解一定时间后,石墨电极上有铜析出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以铝土矿(主要成分为Al2O3,含SiO2和Fe2O3等杂质)为原料生产铝和氮化铝的一种工艺流程如下【已知:SiO2在“碱溶”时转化为铝硅酸钠(NaAlSiO4·nH2O)沉淀】。

(1)操作I、Ⅱ的名称为____________。
(2)用氧化物的形式表示铝硅酸钠的化学式_____________。
(3)溶液a中加入NaHCO3后,生成沉淀的离子方程式为____________。
(4)Al2O3比另外一种铝的化合物AlCl3熔点高出很多,原因是_________;有人考虑用熔融态AlCl3电解制备铝,你觉得是否可行,____(选填“可行”或“不可行”),试分析原因_________。
(5)取一定量的样品,用以下装置测定样品中AlN的纯度(夹持装置已略去)。打开K2,加入NaOH浓溶液,至不再产生NH3。打开K1,通入N2一段时间。

①实验中需要测定的数据是___________。
②由于装置存在缺陷,导致测定结果偏高,请提出改进方法:___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】写出下列反应的热化学方程式:
(1)N2和H2反应生成34g NH3,放出92kJ热量____________________。
(2)1molCH4(g)在O2中完全燃烧生成CO2和H2O(g),放出890.3kJ热量________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环境污染已成为人类社会面临的重大威胁,各种污染数不胜数,下列名词与环境污染无关的是( )
①温室效应 ②赤潮 ③酸雨 ④光化学污染 ⑤臭氧层空洞 ⑥水俣病 ⑦潮汐 ⑧大脖子病
A.①②
B.⑦⑧
C.⑥⑦⑧
D.②⑤⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】己知:CH3CH2OH+NaBr+H2SO4(浓) ![]() CH3CH2Br+NaHSO4 +H2O。实验室制备溴乙烷(沸点为38.4℃) 的装置如图: 圆底烧瓶中加入10mL 95%乙醇、28mL浓硫酸,然后加入研细的10.3g溴化钠和几粒碎瓷片,小火加热,使NaBr充分反应。
CH3CH2Br+NaHSO4 +H2O。实验室制备溴乙烷(沸点为38.4℃) 的装置如图: 圆底烧瓶中加入10mL 95%乙醇、28mL浓硫酸,然后加入研细的10.3g溴化钠和几粒碎瓷片,小火加热,使NaBr充分反应。
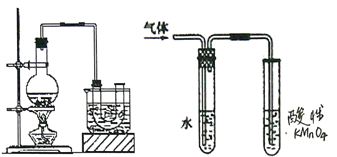
(1)反应时若温度过高会降低溴乙烷的产率,原因是______;也可看到有红棕色气体产生,该气体的化学式为_________。为避免温度过高,宜采用_________加热。
(2)反应结束后,U形管中粗制的溴乙烷呈棕黄色。为了除去其中的杂质,最好选用下列试剂中的_______(填序号)。
A.Na2SO3溶液B.H2OC.NaOH溶液D.CCl4
(3)溴乙烷在NaOH水溶液和NaOH乙醇溶液发生不同类型的反应,生成不同的产物,用上面右图所示装置进行实验:该实验的目的是________。盛水的试管(装置)的作用是____。
(4)为检验溴乙烷中的溴元素,正确的操作顺序是:取少量溴乙烷,然后______(填序号)。
①加热 ②加入AgNO3溶液 ③加入稀HNO3酸化 ④加入NaOH溶液 ⑤冷却
(5)经提纯最终得到纯净的溴乙烷为7.63g,则溴乙烷的产率为______ (保留两位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校化学研究性学习小组设计如下实验方案,测定NaHCO3和Na2CO3混合物中NaHCO3的质量分数。按下图装置进行实验。并回答以下问题。

①按图组装仪器并检查装置的气密性。
②实验前称取17.90g样品,从分液漏斗滴入6mol·L-1的硫酸,直到不再产生气体时为止, 从导管A处缓缓鼓入一定量的空气。
③实验结束后测得U型管增重 8.80g。
(1)B瓶中装的试剂为___________________,C装置的作用是___________________________。
(2)从导管A处缓缓鼓入一定量的空气的目的是_______________________。
(3)该样品中NaHCO3的质量分数为_______________________(保留三位有效数字)。
(4)现有等物质的量浓度的NaHCO3溶液和Na2CO3溶液各一瓶,请选择正确的方法进行鉴别____。
A.加热法:产生使澄清石灰水变浑浊气体的是NaHCO3
B.沉淀法:加入BaCl2溶液,产生沉淀的是Na2CO3溶液
C.气体法:逐滴加入盐酸,立即产生气泡的是NaHCO3溶液
D.测pH法:用pH试纸测其pH,pH大的是Na2CO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列用品的主要成分不正确的是
A | B | C | D | |
用品 | 水玻璃 | “84”消毒液 | 小苏打 | 光导纤维 |
主要成分 | Na2SiO3 | NaClO | NaHCO3 | Si |
A. A B. B C. C D. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com