
用NA表示阿伏德罗常数,下列叙述正确的是 ( )
A.标准状况下,22.4LH2O含有的分子数为 NA
B.通常状况下,NA 个CO2分子占有的体积为22.4L
C.物质的量浓度为1mol/L的MgCl2溶液中,含有Cl—个数为2NA
D.常温常压下,1.06g Na2CO3含有的Na+离子数为0.02 NA
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
下列说法中正确的是( )
A.处于最低能量的原子叫做基态原子
B.3p2表示3p能级有两个轨道
C.同一原子中,1s、2s、3s电子的能量逐渐减小
D.同一原子中,2p、3p、4p能级的轨道数依次增多
查看答案和解析>>
科目:高中化学 来源: 题型:
250C时,0.1mol·L-1稀醋酸加水稀释,如图中的纵坐标y可以是( )

A.溶液的pH B.醋酸的电离平衡常数
C.溶液的导电能力 D.醋酸的电离程度
查看答案和解析>>
科目:高中化学 来源: 题型:
运用化学反应原理研究氮、硫、氯、碘等单质及其化合物的反应有重要意义.
(1)硫酸生产中,SO2催化氧化生成SO3:2SO2(g)+O2(g) 2SO3(g),混合体系中SO3的百分含量和温度的关系如下图1所示(曲线上任何一点都表示平衡状态).根据图示回答下列问题:
2SO3(g),混合体系中SO3的百分含量和温度的关系如下图1所示(曲线上任何一点都表示平衡状态).根据图示回答下列问题:
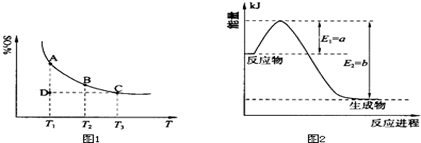
①恒温、恒压条件下,反应2SO2(g)+O2(g) 2SO3(g)达平衡,向体系中通入氦气,平衡 移动(填“向左”、“向右”或“不”);
2SO3(g)达平衡,向体系中通入氦气,平衡 移动(填“向左”、“向右”或“不”);
②若温度为T1、T2,反应的平衡常数分别为K1、K2,则K1 K2(填“>”、“<”或“=”,下同);若反应进行到状态D时,v正 v逆(填“>”、“<”或“=”)。
(2)氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用.
①上图2是一定的温度和压强下是N2和H2反应生成1molNH3过程中能量变化示意图,请写出工业合成氨的热化学反应方程式: .
(△H的数值用含字母a、b的代数式表示)
②氨气溶于水得到氨水.在25℃下,将a mol•L-1的氨水与b mol•L-1的盐酸等体积混合,反应后溶液恰好显中性,用含a和b的代数式表示出氨水的电离平衡常数表达式 。
(3)已知25°C时Ksp[AgCl]=1.6×10-10mol2•L-2,Ksp[AgI]=1.5×10-16mol2•L-2),在25℃下,向0.1L0.002mol•L-1的NaCl溶液中逐滴加入0.1L0.002mol•L-1硝酸银溶液,有白色沉淀生成.从沉淀溶解平衡的角度解释产生沉淀的原因是 ,向反应后的浊液中,继续加入0.1L0.002mol•L-1的NaI 溶液,看到的现象是 ,产生该现象的原因是(用离子方程式表示) 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验操作中数据合理的是 ( )
A.用10 mL 量筒量取5.2 mL盐酸 B.用pH试纸测得某溶液的pH值为12.5
C.用托盘天平称取25.12gNaCl固体 D.用100 mL容量瓶配制50mL0.1 mol/L的盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
取1.43g Na2CO3·10H2O溶于水配成100ml溶液,求:(要求写出计算过程)
(1)Na2CO3物质的量浓度;
(2)Na+ 物质的量浓度;
(3)取出20ml该溶液用蒸馏水稀释,使Na2CO3溶液物质的量浓度变为0.04mol/L,求加入蒸馏水的体积(设稀释时,对溶液体积的影响忽略不计)。
查看答案和解析>>
科目:高中化学 来源: 题型:
某强酸性溶液X中含有Ba2+、Al3+、SiO32-、NH4+、Fe2+、Fe3+、CO32-、SO42-、NO3-中的一种或几种离子,取该溶液进行连续实验,能实现如下转化:

根据以上信息,请回答下列问题:
(1)溶液X中除含H+、Al3+、NH4+、SO42-外肯定还含有的离子是 ,不能确定是否含有的离子是 ,若要确定不能确定的阳离子是否存在,最可靠方法是: 。
(2)沉淀E的化学式为 。
(3)反应①、②、③、④中,不属于氧化还原反应的是 (填序号)
(4)写出步骤①中生成气体A的离子方程式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
运用相关化学知识进行判断,下列结论错误的是( )
A.某吸热反应能自发进行,因此该反应是熵增反应
B.NH4F水溶液中含有HF,因此NH4F溶液不能存放于玻璃试剂瓶中
C.可燃冰主要是甲烷与水在低温高压下形成的水合物晶体,因此可存在于海底
D.增大反应物浓度可加快反应速率,因此用浓硫酸与铁反应能增大生成H2的速率
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com