
【题目】锂-硫电池具有高能量密度、续航能力强等特点。使用新型碳材料复合型硫电极的锂-硫电池工作原理示意图如图,下列说法正确的是
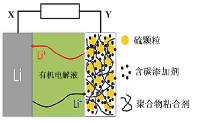
A.电池放电时,X电极发生还原反应
B.电池充电时,Y电极接电源正极
C.电池放电时,电子由锂电极经有机电解液介质流向硫电极
D.向电解液中添加Li2SO4水溶液,可增强导电性,改善性能
科目:高中化学 来源: 题型:
【题目】加工含硫原油时,需除去其中含硫物质。
(1)铁离子浓度是原油加工中防腐监测的重要指标。测定铁离子浓度前,需去除原油加工产生的酸性废水中的硫化氢及其盐。实验室模拟过程如下。
Ⅰ.将250mL酸性废水置于反应瓶中,加入少量浓盐酸,调节pH小于5。
Ⅱ.在吸收瓶中加入饱和氢氧化钠溶液。
Ⅲ.打开脱气—吸收装置,通入氮气,调节气流速度,使气体依次经过反应瓶和吸收瓶。当吹出气体中H2S体积分数达到标准,即可停止吹气。
已知:含硫微粒的物质的量分数(δ)随pH变化情况如下图所示。
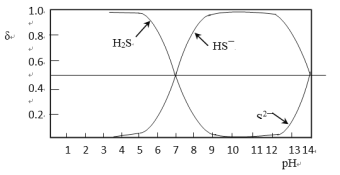
①步骤Ⅰ中加入浓盐酸调节pH<5的原因是_______________________。
②步骤Ⅱ中,当测得吸收液的pH为 ______时,需要更换NaOH溶液。
③利用邻菲罗啉分光光度法可测定样品中的含铁量。测定前需用盐酸羟基胺(NH2OH·HCl)将Fe3+还原为Fe2+。将下述离子方程式补充完整:_______Fe3++______NH2OH·HCl=____Fe2++N2↑+________+_________+__________Cl-
(2)原油中的硫化氢还可采用电化学法处理,并制取氢气,其原理如下图所示。
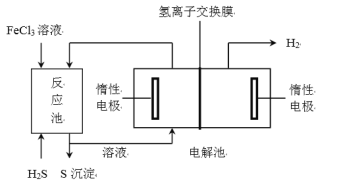
①写出反应池内发生反应的离子方程式_____________________________________。
②电解池中,阳极的电极反应为_____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示是一系列含硫化合物的转化关系(反应中生成的水已略去),其中说法正确的是
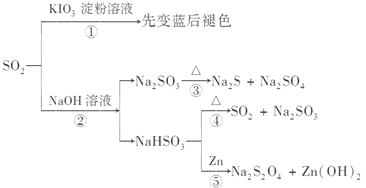
A.反应①说明SO2具有漂白性,反应②说明SO2具有酸性
B.反应②中生成物n(Na2SO3):n(NaHSO3)=1:1时,则反应物n(SO2):n(NaOH)=1:2
C.反应③④⑤均属于氧化还原反应
D.工业上可利用反应②和反应④回收SO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表:
物质 | X | Y | Z |
初始浓度/mol·L-1 | 0.1 | 0.2 | 0 |
平衡浓度/mol·L-1 | 0.05 | 0.05 | 0.1 |
下列说法错误的是
A. 反应达到平衡时,X的转化率为50%
B. 反应可表示为X+3Y![]() 2Z
2Z
C. 增大压强使平衡向生成Z的方向移动,平衡常数增大
D. 升高温度平衡常数增大,则此反应为吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮及其化合物的转化过程如图所示。下列分析合理的是

A. 催化剂a表面发生了极性共价键的断裂和形成
B. N2与H2反应生成NH3的原子利用率为100%
C. 在催化剂b表面形成氮氧键时,不涉及电子转移
D. 催化剂a、b能提高反应的平衡转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)25℃时,0.1mol/L HCl溶液中由水电离出的H+的浓度为_______;
(2)若向氨水中加入少量硫酸铵固体,此时溶液中![]() 将_______;(填“增大”、“减小”或“不变”)
将_______;(填“增大”、“减小”或“不变”)
(3)25℃时,向AgNO3溶液中加入BaCl2溶液和KBr溶液,当两种沉淀共存时,![]() =____;[已知:25℃时,Ksp(AgBr)=5.4×10-13,Ksp(AgCl)=2.0×10-10 ]
=____;[已知:25℃时,Ksp(AgBr)=5.4×10-13,Ksp(AgCl)=2.0×10-10 ]
(4)用离子方程式表示NH4F不能用玻璃试剂瓶装的原因________;
(5)25℃时,有下列四种溶液:A. 0.1mol/L CH3COONH4溶液 B. 0.1mol/L CH3COOH溶液 C.0.1mol/L CH3COONa溶液 D.等体积0.4mol/L CH3COOH溶液和0.2mol/L NaOH溶液的混合液(混合液呈酸性)
① 已知A溶液呈中性,试推断(NH4)2CO3溶液呈______性(填“酸”或“碱”或“中”);
② D溶液中除H2O外所有分子、离子浓度由大到小的顺序为________;
③ 上述四种溶液中水的电离程度由小到大的顺序为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取一支硬质大试管,通过排饱和食盐水的方法先后收集半试管甲烷和半试管氯气(如图),下列对于试管内发生的反应及现象的说法正确的是:

A. 为加快化学反应速率,应在强光照射下完成
B. 甲烷和 Cl2 反应后试管内壁的油状液滴物包括 CH3Cl 、CH2Cl2、CHCl3、CCl4
C. 盛放饱和食盐水的水槽底部会有少量晶体析出
D. CH4 和 Cl2 完全反应后液面上升,液体充满试管
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关微粒间作用力的说法正确的是
A. 硼酸[B(OH)3]晶体具有与石墨相似的层状结构,则分子中B原子发生的是sp3杂化,不同层分子间主要作用力是范德华力
B. 金属键可以看作是许多原子共用许多电子所形成的强烈的相互作用,所以与共价键类似也有方向性和饱和性
C. 干冰气化和冰融化克服的分子间作用力相同
D. 离子晶体熔融状态电离过程中,只有离子键被破坏
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学用语对事实的表述不正确的是
A. 由Na和Cl形成离子键的过程:![]()
B. Na2S做沉淀剂可处理含Hg2+的工业污水:Hg2++S2-=HgS↓
C. CH3COOH溶液与NaOH溶液反应放出热量H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ·mol-1
D. 闪锌矿(ZnS)经CuSO4溶液作用转化为铜蓝(CuS):ZnS+Cu2+=CuS+Zn2+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com