
| A. | S+O2═2SO2;△H=-269kJ/mol(反应热) | |
| B. | 2NO2(g)═O2(g)+2NO(g);△H=+116.2kJ/mol(反应热) | |
| C. | C2H5OH(l)+3O2(g)═2CO2(g)+3H2O(g);△H=-1367.0kJ/mol(燃烧热) | |
| D. | NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l);△H=+57.3kJ/mol(中和热) |
分析 A.热化学方程式中必须注明物质所处状态;
B.二氧化氮分解生成氧气和NO的反应为吸热反应;
C.燃烧热是指1mol纯净物完全燃烧生成稳定的氧化物放出的热量,液态水比气态水稳定,
D.中和反应为放热反应,则中和热为负值.
解答 解:A.物质所处状态影响具有能量,所以热化学方程式中必须注明其状态,故A错误;
B.二氧化氮分解的热化学方程式为:2NO2(g)═O2(g)+2NO(g)△H=+116.2kJ/mol(反应热),故B正确;
C.乙醇燃烧热中液态水更稳定,正确的热化学方程式为:C2H5OH(l)+3O2(g)═2CO2(g)+3H2O(l)△H=-1367.0kJ/mol(燃烧热),故C错误;
D.中和反应为放热反应,则△H<0,正确的热化学方程式为:NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l)△H=-57.3kJ/mol(中和热),故D错误;
故选B.
点评 本题考查了热化学方程式的书写判断,题目难度不大,明确燃烧热、中和热的概念为解答关键,注意掌握热化学方程式的书写原则,试题侧重基础知识的考查,有利于提高学生的分析能力及灵活应用能力.


 仁爱英语同步练习册系列答案
仁爱英语同步练习册系列答案 学习实践园地系列答案
学习实践园地系列答案科目:高中化学 来源: 题型:解答题
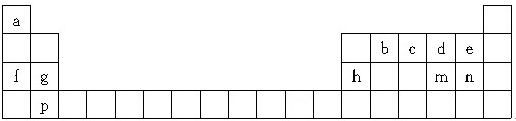
 ,其中含有的
,其中含有的查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2O═H++OH- | B. | 2H2O?H3O++OH- | C. | H2O?2H++O2- | D. | H++OH-═H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CaCO3 | B. | Na2SO3 | C. | H2SO4 | D. | Ca(OH)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
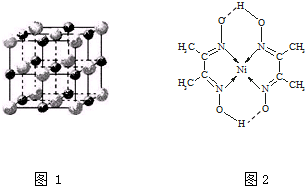 (1)已知A和B为第三周期元素,其原子的第一至第四电离能如表1所示:
(1)已知A和B为第三周期元素,其原子的第一至第四电离能如表1所示:| 电离能/kJ•mol-1 | I1 | I2 | I3 | I4 |
| A | 578 | 1817 | 2745 | 11578 |
| B | 738 | 1451 | 7733 | 10540 |
| 共价键 | C-C | C-N | C-S |
| 键能/kJ•mol-1 | 347 | 305 | 259 |
| 离子晶体 | NaCl | KCl | CaO |
| 晶格能(kJ•mol-1) | 786 | 715 | 3401 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
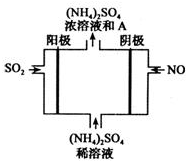 经研究发现,含pM2.5的雾霾主要成分有SO2、NOx、CxHy,及可吸入颗粒等.
经研究发现,含pM2.5的雾霾主要成分有SO2、NOx、CxHy,及可吸入颗粒等.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
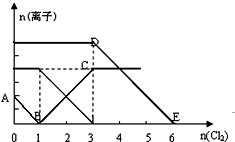 向含有Fe2+、I-、Br-的溶液中通入适量氯气,溶液中各种离子的物质的量变化如图所示.有关说法正确的是( )
向含有Fe2+、I-、Br-的溶液中通入适量氯气,溶液中各种离子的物质的量变化如图所示.有关说法正确的是( )| A. | 线段BC代表Cl-数目的变化情况 | |
| B. | 原混合溶液中c(FeBr2)=6mol/L | |
| C. | 当通入Cl22mol时,溶液中已发生的离子反应可表示为:2Fe2++2I-+2Cl2→2Fe3++I2+4 Cl- | |
| D. | 原溶液中n(Fe2+):n(I-):n(Br-)=2:1:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某电中性单核粒子含有6个电子、7个中子,该粒子是${\;}_{6}^{13}$C | |
| B. | 在Na+、O2-、Cl、Cl-四种粒子中,半径最大的是Cl-,半径最小的是Na+ | |
| C. | 在离子RO3n-中共有x个核外电子,R原子的质量数为A,则R原子核内含有的中子数目是A-x+n+24 | |
| D. | 硫离子的结构示意图为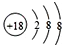 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com