
【题目】某化学小组需要480 mL 0.1000 mol/L的NaOH溶液。欲在实验室用固体烧碱配制。请回答下列问题:

(1)本实验需用托盘天平称量烧碱的质量为_____g。
(2)配制过程中,不需要的仪器(填写代号)________________。
a.烧杯 b.冷凝管 c.玻璃棒 d.1000mL容量瓶 e.漏斗 f.胶头滴管
(3)根据实验需要和(2)所列仪器判断,完成实验还缺少的仪器有药匙、___、___。
(4)请说出本实验中玻璃棒的作用____________。
(5)将上图中的实验步骤A~F按实验过程先后次序排列______________。
(6)若配制过程中,其他操作都准确,下列操作能引起浓度偏高的有______(填代号)。
①用来溶解NaOH的烧杯里面有少许水
②未等稀释后的NaOH溶液冷却至室温就转移到容量瓶中
③将NaOH溶液转移到容量瓶时,不小心撒到了外面少许
④定容时,加蒸馏水超过刻度线,又用胶头滴管吸出
⑤转移前,容量瓶中含有少量蒸馏水
⑥定容摇匀后,发现液面低于刻度线,又用胶头滴管加蒸馏水至刻度线
⑦定容时,俯视刻度线
【答案】2.0 bde 托盘天平 500mL容量瓶 搅拌、引流 CBDFAE ②⑦
【解析】
本题考察配制一定的物质的量浓度溶液。
(1)由于没有480mL的容量瓶,需要使用500mL的容量瓶来配制溶液,所以n(NaOH)=500×10-3L×0.1000mol/L=0.05mol,m(NaOH)=0.05mol×40g/mol=2g,由托盘天平称量为2.0g;
(2)配制过程中,不需要使用冷凝管、1000mL容量瓶、漏斗,即bde为合理选项;
(3)由(1)(2)得知,还缺少500mL容量瓶和托盘天平;
(4)玻璃棒的作用有搅拌(溶解NaOH)、引流(转移溶液);
(5)该实验的步骤有:计算、称量、溶解、冷却、转移、洗涤、定容、摇匀、贴标签,所以按实验过程先后次序排列为CBDFAE;
(6)①配制好的溶液的体积以容量瓶刻度线为准,烧杯中有少量的水不会影响溶液的体积,所以①对实验结果无影响,①错误;
②NaOH固体遇水放热,未冷却就转移至容量瓶中,定容后溶液体积会变小,所以溶液的浓度会偏高,②正确;
③转移溶液时,洒出会使得NaOH的物质的量减小,所以溶液浓度会偏低,③错误;
④定容时,加水超过刻度线后,用胶头滴管再吸取一部分,会使得NaOH的物质的量减少,所以溶液浓度会偏低,④错误;
⑤转移前容量瓶中有水,并不影响溶液的体积,所以溶液浓度不受影响,⑤错误;
⑥定容摇匀后,发现液面低于刻度线,是因为有少量液体附着在刻度线上方的器壁上,这时不能补加蒸馏水,否则溶液溶度会偏小,⑥错误;
⑦定容时,视线一直盯着刻度线,如果俯视,会造成溶液体积偏小,溶液浓度偏高,⑦正确;
故合理选项为②⑦。


科目:高中化学 来源: 题型:
【题目】在150℃,由任意比例组成的混合气体1L,在9L过量的氧气中充分燃烧后,恢复到反应前的温度,体积仍为10L,则该混合气体的成分可能是
A. C2H4和C3H4B. CH4和C2H6C. CH4和C2H2D. C2H6和C3H6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗常数。下列说法正确的是
A. 标准状况下,22.4LCH4中含有氢原子数目为4NA
B. 1molNa2O2中含有的阴离子和阳离子的数目都是2NA
C. 0.1mol/LCu(NO3)2溶液中含有的NO3-数目为0.2NA
D. 28gN2中所含的原子数目是NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“清肺排毒汤”对新冠肺炎病毒感染具有良好的效果,其中一味中药黄芩的一种活性中间体的结构为: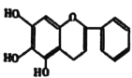 ,现在可人工合成,路线如图所示:
,现在可人工合成,路线如图所示:
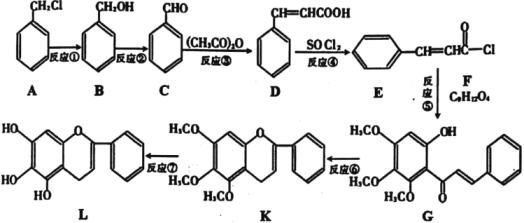
(1)A生成B的反应条件是___,B生成C的反应条件为___。
(2)合成过程中,属于取代反应的是___。
(3)F的结构简式为___。
(4)D在一定条件下能生成高分子化合物,请写出该反应的化学方程式___。同时符合下列三个条件的D的同分异构体共有___种。
a.能发生银镜反应;
b.苯环上有3个取代基;
c.与FeCl3溶液发生显色反应。
(5)依据以上合成信息,以乙烯和氯苯为原料合成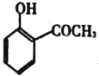 路线,无机试剂自选___。
路线,无机试剂自选___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分别放在0.1 molL-1H2SO4溶液中的四块相同的纯锌片,其连接情况如图所示:

(1)其腐蚀速率由快到慢的顺序是________;
(2)写出②号内正极发生的电极反应式_________;
(3)若③号烧杯内的电解质溶液为NaCl溶液,则Zn电极发生的电极反应式为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】针对下面11种元素,完成以下各小题。
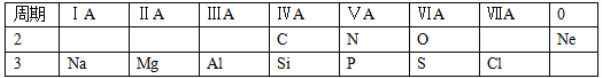
(1)地壳中含量最多的元素是________(填元素符号)
(2)化学性质最不活泼的元素是___________(填名称)
(3)Cl的离子结构示意图为_____________
(4)C与N相比,原子半径较小的是_______(填元素名称)
(5)最高价氧化物对应的水化物碱性最强的是___________(填化学式)
(6)MgO和![]() 中,属于两性氧化物的是_________________
中,属于两性氧化物的是_________________
(7)P、S、Cl的最高价氧化物对应水化物酸性最强的是___________(填物质名称)
(8)可用来制造计算机芯片的物质是______,晶体硅的主要用途是___________(写出一种)。
(9)在S与Cl的单质中,化学性质较活泼的单质是______________(填化学式)可用什么化学反应说明该事实(写出反应的化学方程式):______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究发现,可以用石墨作阳极、钛网作阴极、熔融CaF2—CaO作电解质,利用图示装置获得金属钙,并以钙为还原剂还原二氧化钛制备金属钛。下列说法中正确的是( )
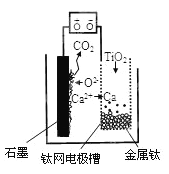
A. 将熔融CaF2—CaO换成Ca(NO3)2溶液也可以达到相同目的
B. 阳极的电极反应式为:C+2O2--4e-=CO2↑
C. 在制备金属钛前后,整套装置中CaO的总量减少
D. 石墨为阴极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO和H2是工业上最常用的合成气,该合成气的制备方法很多,它们也能合成许多重要的有机物。回答下列问题:
(1)制备该合成气的一种方法是以CH4和H2O为原料,有关反应的能量变化如图所示。
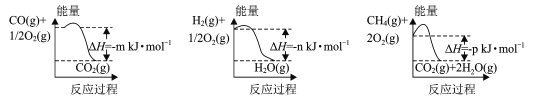
CH4 (g)与H2O(g)反应生成CO(g)和H2 (g)的热化学方程式为____。
(2)工业乙醇也可用CO和H2合成,常含一定量甲醇,各国严禁使用成本低廉的工业酒精勾兑食用酒,但一般定性的方法很难检测出食用酒中的甲醇。有人就用硫酸酸化的橙色K2Cr2O7溶液定量测定混合物中甲醇的含量,甲醇与酸性K2Cr2O7溶液反应生成CO2、Cr2(SO4)3等物质,写出其化学方程式 ___________。
(3)为了检验由CO和H2合成气合成的某有机物M的组成,进行了如下测定:将1.84gM在氧气中充分燃烧,将生成的气体混合物通过足量的碱石灰,碱石灰 增重4. 08 g,又知生成CO2和H2O的物质的量之比为3:4。则M中碳、氢、氧原子个数之比为____。
(4) CO2和H2合成甲醇涉及以下反应:CO2(g)+3H2(g)CH3OH(g)+H2O(g) H=-49.58kJ/mol。在反应过程中可以在恒压的密闭容器中,充入一定量的CO2和H2,测得不同温度下,体系中CO2的平衡转化率与压强的关系曲线如图所示:
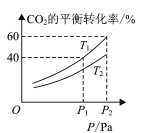
①反应过程中,表明反应达到平衡状态的标志是______;
A.生成3mol O-H键,同时断裂3mol H-H键 B.容器中气体的压强不再变化
C.容器中气体的平均摩尔质量不变 D.CH3OH的浓度不再改变
②比较T1与T2的大小关系:T1 ___T2 (填“<”、“=”或“>”)。
③在T1和P2的条件下,向密闭容器中充入1mol CO2和3mol H2,该反应在第5 min时达到平衡,此时容器的容积为2.4 L,则该反应在此温度下的平衡常数为____,保持T1和此时容器的容积不变,再充入1mol CO2和3mol H2,设达到平衡时CO2的总转化率为a,写出一个能够解出a的方程或式子 ___(不必化简,可以不带单位)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向200mLFeCl3与HCl的混合溶液中,分别加入一定量成分均匀的Fe、Cu混合固体,充分反应后剩余固体的质量及放出气体的体积(标准状况下测得)如下表所示。
加入固体质量/g | 9.00 | 18.0 | 27.0 |
剩余固体质量/g | 3.20 | 9.60 | 15.8 |
放出气体体积/L | 0 | 1.12 | 2.24 |
试计算:
(1)原混合液中c(Cl-)=____。
(2)混合固体中n(Fe):n(Cu)=____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com