
| A、向Ag2CrO4的浊液中加入AgNO3溶液,Ag2CrO4的Ksp减小 |
| B、将0.001 mol?L-1的AgNO3溶液逐滴加入到含Cl-和CrO42-浓度均为0.001 mol?L-1的溶液中,则先产生AgCl沉淀 |
| C、饱和AgCl溶液与饱和Ag2CrO4溶液相比,前者的c(Ag+)大 |
| D、该温度下,AgCl在水中的溶解度小于在食盐水中的溶解度 |
| 3 | 2×10-12 |
| 1.56×10-10 |
| 1.56×10-10 |
| 10-3 |
|
| 3 | 2×10-12 |
| 1.56×10-10 |


 优质课堂快乐成长系列答案
优质课堂快乐成长系列答案科目:高中化学 来源: 题型:
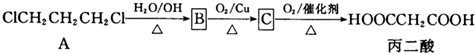
| 丙二酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
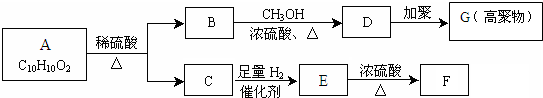
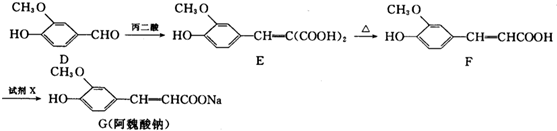
 ,F能使溴的CCl4溶液褪色.请回答下列问题:
,F能使溴的CCl4溶液褪色.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 某温度时,BaSO4在水中的沉淀溶解平衡:BaSO4(s)?Ba2+(aq)+SO42-(aq)Ksp=c(Ba2+)?c(SO42-),沉淀溶解平衡曲线如图所示,下列说法正确的是( )
某温度时,BaSO4在水中的沉淀溶解平衡:BaSO4(s)?Ba2+(aq)+SO42-(aq)Ksp=c(Ba2+)?c(SO42-),沉淀溶解平衡曲线如图所示,下列说法正确的是( )| A、b点时c(Ba2+)?c(SO42- )小于Ksp |
| B、a点对应的Ksp等于c点对应的Ksp |
| C、加水稀释可以使溶液由b点变到c点 |
| D、加入适量的Na2SO4不可能使溶液由a点变到c点 |
查看答案和解析>>
科目:高中化学 来源: 题型:
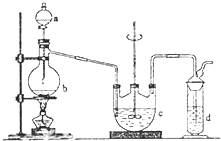 在实验室中可通过如下反应制取硫代硫酸钠Na2S2O3:2Na2S+Na2CO3+4SO2═3Na2S2O3+CO2
在实验室中可通过如下反应制取硫代硫酸钠Na2S2O3:2Na2S+Na2CO3+4SO2═3Na2S2O3+CO2查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com