
����һ����ѧ��Ӧ���о���Ҫ�ӷ�Ӧ�������ȡ����ʡ�������ϵ�����ؽ����ۺϷ����������ǹ��ڻ�ѧ��Ӧ��ϵ���о�������������Ϣ�ش����⡣
�Ź��ڷ�Ӧ��֮��Ķ�����ϵ���о���
��֪��Ӧ��Br2 +2Fe2+=2 Br -+2Fe3+,��10mL0 .1mol/L��Fe Br2��Һ��ͨ��0 .003mol Cl2���÷�Ӧ�����ӷ���ʽΪ
�ƹ��ڷ�Ӧ���ʡ��ȵ��о���
����֪298Kʱ��Mg(OH)2���ܶȻ�����Ksp��5.6��10��12�����Ȼ�þ��Һ�м���һ�������ռ���pH=13.0,����¶��²�������Һ�е�c(Mg 2+)��
�ڿ�ѧ�о�����������Cu2O����Ϊ̫����ֽ�ˮ�Ĵ�����
һ���¶��£���2L�ܱ������м���������Cu2O��ͨ��0 .1molˮ������������Ӧ��
2 H2O(g)
2 H2 (g) + O2(g) ��H��+484kJ�� mol-1����ͬʱ�β���O2�������±���
| ʱ��/min | 20 | 40 | 60 | 80 |
| n(O2)/mol | 0.0010 | 0.0016 | 0.0020 | 0.0020 |
��ǰ20min�ķ�Ӧ����v(H2O)= ���ﵽƽ��ʱ��������Ҫ���յĹ���Ϊ kJ��
����ij�ܱ������м���0 .3molA��0 .1molC��һ������B�������塣һ�������·�����Ӧ��������Ũ����ʱ��仯����ͼ�м�ͼ��ʾ����ͼ����ͼΪt2ʱ�̺�ı�������������ƽ����ϵ�з�Ӧ������ʱ��仯����������ĸ��ζ�ֻ�ı�һ����������֪t3��t4Ϊʹ�ô�������ͼ��t0��t1��c (B)δ��������ش�
��t4��t5�θı�������� t5��t6�θı��������
��B����ʼŨ��Ϊ ���÷�Ӧ����ʽΪ
 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
| Cu2O |
| ʱ��/min | 20 | 40 | 60 | 80 |
| n��O2��/mol | 0.0010 | 0.0016 | 0.0020 | 0.0020 |

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2010-2011ѧ�꽭��ʡ������ѧ�ڵ�һ��ģ�⿼�ԣ����ۣ���ѧ���� ���ͣ���ѧ��
����һ����ѧ��Ӧ���о���Ҫ�ӷ�Ӧ�������ȡ����ʡ�������ϵ�����ؽ����ۺϷ����������ǹ��ڻ�ѧ��Ӧ��ϵ���о�������������Ϣ�ش����⡣
�Ź��ڷ�Ӧ��֮��Ķ�����ϵ���о���
��֪��Ӧ��Br2 +2Fe2+=2 Br -+2Fe3+,��10 mL0 .1mol/L��Fe Br2��Һ��ͨ��0 .003mol Cl2���÷�Ӧ�����ӷ���ʽΪ
�ƹ��ڷ�Ӧ���ʡ��ȵ��о���
����֪298Kʱ��Mg(OH)2���ܶȻ�����Ksp��5.6��10��12�����Ȼ�þ��Һ�м���һ�������ռ���pH=13.0,����¶��²�������Һ�е�c(Mg 2+)��
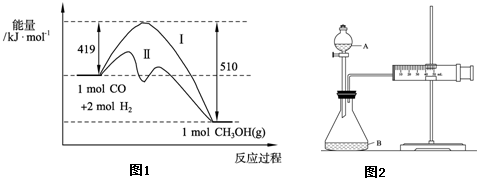
�ڿ�ѧ�о�����������Cu2O����Ϊ̫����ֽ�ˮ�Ĵ�����
һ���¶��£���2L�ܱ������м���������Cu2O��ͨ��0 .1molˮ������������Ӧ��
 2 H2O(g)
2 H2O(g)
2 H2 (g) + O2(g) ��H��+484kJ�� mol-1����ͬʱ�β���O2�������±���
|
ʱ��/min |
20 |
40 |
60 |
80 |
|
n(O2)/mol |
0.0010 |
0.0016 |
0.0020 |
0.0020 |
��ǰ20min�ķ�Ӧ����v(H2O)= ���ﵽƽ��ʱ��������Ҫ���յĹ���Ϊ kJ��
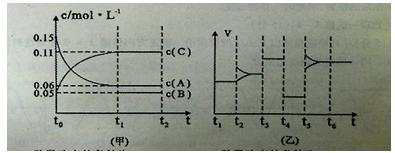
����ij�ܱ������м���0 .3molA��0 .1molC��һ������B�������塣һ�������·�����Ӧ��������Ũ����ʱ��仯����ͼ�м�ͼ��ʾ����ͼ����ͼΪt2ʱ�̺�ı�������������ƽ����ϵ�з�Ӧ������ʱ��仯����������ĸ��ζ�ֻ�ı�һ����������֪t3��t4Ϊʹ�ô�������ͼ��t0��t1��c (B)δ��������ش�

��t4��t5�θı�������� t5��t6�θı��������
��B����ʼŨ��Ϊ ���÷�Ӧ����ʽΪ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2011�콭��ʡ�ٴ����и�����ѧ�ڵ�һ��ģ�⿼�ԣ����ۣ���ѧ���� ���ͣ������
����һ����ѧ��Ӧ���о���Ҫ�ӷ�Ӧ�������ȡ����ʡ�������ϵ�����ؽ����ۺϷ����������ǹ��ڻ�ѧ��Ӧ��ϵ���о�������������Ϣ�ش����⡣
�Ź��ڷ�Ӧ��֮��Ķ�����ϵ���о���
��֪�� Ӧ��Br2 +2Fe2+=2 Br -+2Fe3+,��10 mL0 .1mol/L��Fe Br2��Һ��ͨ��0 .003mol Cl2���÷�Ӧ�����ӷ���ʽΪ
Ӧ��Br2 +2Fe2+=2 Br -+2Fe3+,��10 mL0 .1mol/L��Fe Br2��Һ��ͨ��0 .003mol Cl2���÷�Ӧ�����ӷ���ʽΪ
�ƹ��ڷ�Ӧ���ʡ��ȵ��о���
����֪298Kʱ��Mg(OH)2���ܶȻ�����Ksp��5.6��10��12�����Ȼ�þ��Һ�м���һ�������ռ���pH=13.0,����¶��²�������Һ�е�c(Mg 2+)��
�ڿ�ѧ�о��� ��������Cu2O����Ϊ̫����ֽ�ˮ�Ĵ�����
��������Cu2O����Ϊ̫����ֽ�ˮ�Ĵ�����
һ���¶��� ����2L�ܱ������м���������Cu2O��ͨ��0 .1molˮ������������Ӧ��
����2L�ܱ������м���������Cu2O��ͨ��0 .1molˮ������������Ӧ��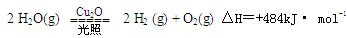 2 H2O(g)
2 H2O(g)
2 H2(g) + O2(g)��H��+484kJ�� mol-1����ͬʱ�β���O2�������±���
| ʱ��/min | 20 | 40 | 60 | 80 |
| n(O2)/mol | 0.0010 | 0.0016 | 0.0020 | 0.0020 |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com