
【题目】在两份相同的Ba(OH)2溶液中,分别滴入物质的量浓度相等的H2SO4、NaHSO4溶液,其导电能力随滴入溶液体积变化的曲线如图所示。下列分析正确的是( )
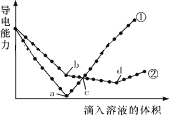
A.②代表滴加H2SO4溶液的变化曲线
B.b点溶液中大量存在的离子是SO42-、Na+、OH-
C.a、d两点对应的溶液均显中性
D.c点两溶液中含有相同量的OH-
【答案】C
【解析】
试题分析:两个反应的方程式为:①Ba(OH)2+H2SO4=BaSO4+2H2O ②Ba(OH)2+NaHSO4=NaOH+BaSO4 +H2O ③NaOH+NaHSO4=Na2SO4+H2O。A、从方程式分析,当氢氧化钡恰好和硫酸完全反应时,溶液的导电能力最小,故①代表滴加硫酸时的变化曲线,故A错误;B、b点是加入硫酸氢钠进行反应②,溶液中含有氢氧化钠,所以不含SO42-,故B错误;C、a点为钡离子和硫酸根离子完全沉淀,d为硫酸钠溶液,溶液都显中性,故C正确;D、c点①曲线为硫酸,②曲线为氢氧化钠和硫酸钠,因为硫酸根离子浓度相 同,因为②中的钠离子浓度大于①中氢离子浓度,所以溶液中的氢氧根离子浓度不相同,故D错误。


 导学教程高中新课标系列答案
导学教程高中新课标系列答案科目:高中化学 来源: 题型:
【题目】下列有关检测生物组织中糖类、脂肪和蛋白质实验的叙述,正确的是
A. 斐林试剂的甲液与双缩脲试剂的A液的化学成分是相同的
B. 还原糖和蛋白质的鉴定过程都需要水浴加热
C. 检测生物组织中的还原糖时可采用西瓜汁作材料
D. 检测花生子叶中的脂肪实验时,可用稀盐酸洗去浮色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用石墨电极完成下列电解实验。
实验一 | 实验二 | |
装置 |
|
|
现象 | a、d处试纸变蓝;b处变红,局部褪色;c处无明显变化 | 两个石墨电极附近有气泡产生;n处有气泡产生;…… |
下列对实验现象的解释或推测不合理的是( )
A.a、d处:2H2O+2e-=H2↑+2OH-
B.b处:2Cl--2e-=Cl2↑
C.根据实验一的原理,实验二中m处能析出铜
D.n处发生了反应:2H++2e-=H2 ↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25 ℃时,将a g NH3完全溶于水,得到V mL pH=8的氨水,假设该氨水的密度为ρ g·cm-3,溶质的质量分数为ω,其中含NH4+的物质的量为b mol,下列叙述中错误的是( )
A.溶质的质量分数为ω=![]() ×100%
×100%
B.溶质的物质的量浓度c=![]() mol·L-1
mol·L-1
C.溶液中c(OH-)=![]() mol·L-1
mol·L-1
D.上述溶液中再加入VmL水后,所得溶液的质量分数小于0.5ω
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向一体积不变的密闭容器中加入2mol A、0.6molC和一定量的B三种气体。一定条件下发生反应,各物质浓度随时间变化如图一所示。图二为t2时刻后改变反应条件,平衡体系中反应速率随时间变化的情况,且四个阶段都各改变一种不同的条件.已知t3-t4阶段为使用催化剂;图一中t0-t1阶段c(B)未画出。

(1)若t1=15min,则t0-t1阶段以C浓度变化表示的反应速率为v(C)=___________.
(2)t4-t5阶段改变的条件为____________,B的起始物质的量为____________。各阶段平衡时对应的平衡常数如下表所示:
t1-t2 | t2-t3 | t3-t4 | t4-t5 | t5-t6 |
K1 | K2 | K3 | K4 | K5 |
K1、K2、K3、K4、K5之间的关系为____________(用“>”、“<”或“=”连接)。
(3)t5-t6阶段保持容器内温度不变,若A的物质的量共变化了0.01mol,而此过程中容器与外界的热交换总量为akJ,写出此温度下该反应的热化学方程式____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,水存在电离平衡H2O(l)![]() H+(aq)+OH-(aq) △H>0,下列叙述一定正确的是
H+(aq)+OH-(aq) △H>0,下列叙述一定正确的是
A.向水中加入KHSO4溶液,平衡逆向移动,Kw减小
B.将水加热,Kw增大,pH减小
C.向水中加入少量固体CH3COONa平衡逆向移动,c(H+)降低
D.向水中加入AlCl3溶液,平衡向右移动,Kw增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com