
| 元素代号 | L | M | X | R | T |
| 原子半径(nm) | 0.160 | 0.143 | 0.102 | 0.089 | 0.074 |
| 主要化合价 | +2 | +3 | +6、-2 | +2 | -2 |
| A、离子半径大小:r(M3+)>r(T2-) |
| B、R的氧化物对应的水化物不可能具有两性 |
| C、X单质在氧气中燃烧生成XO3 |
| D、L、T形成的简单离子核外电子数相等 |


科目:高中化学 来源: 题型:
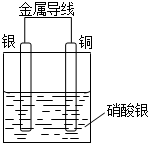 某同学设计出如下装置成功的证明了Cu和Ag的金属活动性顺序.请你原电池原理和实验装置,完成下列实验报告.
某同学设计出如下装置成功的证明了Cu和Ag的金属活动性顺序.请你原电池原理和实验装置,完成下列实验报告.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、升高反应温度 |
| B、增大盐酸的浓度 |
| C、将小锌粒换成大锌粒 |
| D、在盐酸中滴入几滴CuSO4溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
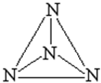 意大利科学家获得了极具研究价值的N4(分子结构如图所示),以下有关物质结构的说法正确的是( )
意大利科学家获得了极具研究价值的N4(分子结构如图所示),以下有关物质结构的说法正确的是( )| A、N均是以SP3杂化,N-N均为σ键 |
| B、N的电负性大于O,所以NH3的沸点低于H2O |
| C、N4为原子晶体,每个N的配位数为3 |
| D、N原子核外有5个未成对电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、手机上用的锂离子电池属于二次电池 |
| B、测定中和反应的反应热,需要记录体系达到的最终温度 |
| C、催化剂能加快化学反应速率是因为降低了反应的活化能,增大了活化分子百分率 |
| D、温度对化学平衡的影响是通过改变平衡常数实现的 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com