
| A. | 制取无水MgCl2,将MgCl2溶液直接蒸干 | |
| B. | 除去CuCl2溶液中含有的少量FeCl2,向溶液中加入过量CuO,待充分反应后过滤 | |
| C. | 的检验:取少量试样于试管中,滴加盐酸酸化的BaCl2溶液,有白色沉淀生成,则试样中含有 | |
| D. | 探究反应的限度:将1mL0.1mol•L-1的KI溶液与5mL0.1mol•L-1的FeCl2溶液混合,待充分反应后,滴加KSCN溶液,观察实验现象 |
分析 A.氯化镁易水解;
B.氧化铜能与氢离子反应;
C.白色沉淀可能为AgCl;
D.KI溶液与FeCl2溶液不反应.
解答 解:A.氯化镁易水解,蒸干得到氢氧化镁,故A错误;
B.氧化铜能与氢离子反应,促进FeCl2水解,可除杂,故B正确;
C.向溶液中滴加盐酸酸化的BaCl2溶液,生成白色沉淀可能为AgCl或硫酸钡,则溶液中可能含银离子或含有SO42-,但二者不能同时存在,故C错误;
D.KI溶液与FeCl2溶液不反应,无法完成实验,故D错误.
故选B.
点评 本题考查化学实验方案评价,为高频考点,涉及物质制备、盐类的水解、离子的检验以及实验探究等,把握反应原理及反应与现象的关系为解答的关键,注意从实验的评价性及物质性质分析解答,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 23gNa与足量H2O反应完全后失去2NA个电子 | |
| B. | 1molCu和足量热浓硫酸反应可生成NA个SO3分子 | |
| C. | 标准状况下,22.4LN2和H2混合气中含2NA个原子 | |
| D. | 3mol单质Fe完全转变为Fe3O4,失去9NA个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
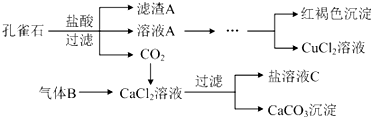
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 难溶物 | CaF2 | CaC2O4 |
| Ksp | 3.5×10-11 | 2.3×10-9 |
| 酸 | HF | H2C2O4 |
| 电离常数 | Ka=7.2×10-4 | Ka1=5.4×10-2 Ka2=5.4×10-5 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 实验室需要0.1mol/L NaOH溶液450mL,需要0.5mol/L硫酸溶液500mL.根据这两种溶液的配置情况回答下列问题:
实验室需要0.1mol/L NaOH溶液450mL,需要0.5mol/L硫酸溶液500mL.根据这两种溶液的配置情况回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
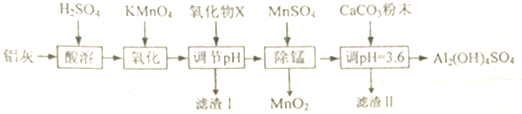
| Al(OH)3 | Fe(OH)2 | Fe(OH)3 | |
| 开始沉淀时 | 3.4 | 6.3 | 1.5 |
| 完全沉淀时 | 4.7 | 8.3 | 2.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4 mol | B. | 2.5 mol | C. | 2 mol | D. | 0.5 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有①②③ | B. | 只有①②③④ | C. | 只有①③④ | D. | 全部 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com