
| 盐酸体积 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 |
| A产生CO2的体积 | 0 | 0 | 0 | 0 | 0 | 22.4 | 44.8 | 44.8 | 44.8 |
| B产生CO2的体积 | 0 | 0 | 22.4 | 44.8 | 67.2 | 89.6 | x | x | x |
| n |
| V |
| 7×10-3mol |
| 0.01L |


 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案科目:高中化学 来源: 题型:
| A、工业上可用电解法制备Mg:MgCl2(熔融)═Mg+Cl2↑ |
| B、向Ca(ClO)2溶液中通入少量CO2:Ca2++2ClO-+H2O+CO2═2HClO+CaCO3↓ |
| C、用CaSO4治理盐碱地:CaSO4(s)+Na2CO3(aq)?CaCO3(s)+Na2SO4(aq) |
| D、用FeSO4除去酸性废水中的Cr2O72-:Cr2O72-+Fe2++14H+═2Cr3++Fe3++7H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、4种 | B、5种 | C、6种 | D、7种 |
查看答案和解析>>
科目:高中化学 来源: 题型:
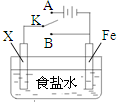
| A、若X为锌棒,开关K置于A处,可减缓铁的腐蚀,这种方法称为牺牲阴极的阳极保护法 | ||||
B、若X为铜棒,开关K置于A处,装置中发生的总反应为2NaCl+2H2O
| ||||
| C、若X为碳棒,开关K置于B处,在铁棒附近滴入硫氰化钾溶液可看到溶液变血红色 | ||||
| D、若X为碳棒,开关K置于B处,向食盐水中滴入酚酞溶液可看到碳棒附近先变红 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 某兴趣小组设计出如图所示装置来改进教材中“铜与硝酸反应”实验,以探究化学实验的绿色化.(固定装置略去)
某兴趣小组设计出如图所示装置来改进教材中“铜与硝酸反应”实验,以探究化学实验的绿色化.(固定装置略去)| 方案 | 反应物 |
| 甲 | Cu、浓HNO3 |
| 乙 | Cu、稀HNO3 |
| 丙 | Cu、Zn、稀HNO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在无色透明溶液中:Al3+、Na+、HCO3-、Cl- |
| B、在能使甲基橙呈红色的溶液中:Mg2+、NH4+、Fe2+、I- |
| C、加入铝粉放出氢气的溶液:K+、Ca2+、NO3-、SO42- |
| D、在水电离产生的H+的浓度为1×10-13mol?L-1的溶液:Cu2+、Na+、NO2-、SO42- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com