
 、乙:HOOH,式中O→O表示配位键,在化学反应中O→O键遇到还原剂时易断裂.化学家Baeyer和Villiyer为研究H2O2的结构,设计并完成了下列实验:a.将C2H5OH与浓H2SO4反应生成(C2H5)2SO4和水;b.将制得的(C2H5)2SO4与H2O2反应,只生成A和H2SO4;c.将生成的A与H2反应(已知该反应中H2做还原剂).
、乙:HOOH,式中O→O表示配位键,在化学反应中O→O键遇到还原剂时易断裂.化学家Baeyer和Villiyer为研究H2O2的结构,设计并完成了下列实验:a.将C2H5OH与浓H2SO4反应生成(C2H5)2SO4和水;b.将制得的(C2H5)2SO4与H2O2反应,只生成A和H2SO4;c.将生成的A与H2反应(已知该反应中H2做还原剂).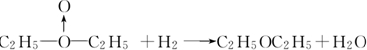 .
.分析 (1)判断分子中能否有提供孤电子对和空轨道的粒子;
(2)硼酸(H3BO3)溶液呈酸性是由于B中含有空轨道,OH-离子提供孤电子对的原因,以此书写离子方程式;
(3)如果存在配位键,则A为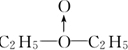 ,如为H0-OH结构,则A为C2H5-O-O-C2H5,与氢气反应的产物不同.
,如为H0-OH结构,则A为C2H5-O-O-C2H5,与氢气反应的产物不同.
解答 解:(1)H3O+中O提供孤电子对,H+提供空轨道,H2SO4中S提供孤电子对,O提供空轨道,二者都能形成配位键,
故答案为:BD;
(2)硼原子为缺电子原子,H3BO3的电离是B原子和水电离的OH-形成配位键,水电离的H+表现酸性,反应的离子方程式为H3BO3+H2O?H++[B(OH)4]-,
故答案为:H3BO3+H2O?H++[B(OH)4]-;
(3)①如果H2O2的结构如甲所示,实验c中A为 ,与氢气反应生成乙醚,方程式为
,与氢气反应生成乙醚,方程式为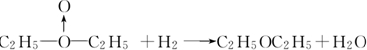 ,
,
故答案为: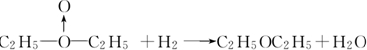 ;
;
②如果H2O2的结构如甲所示,则A为C2H5-O-O-C2H5,与氢气反应生成乙醇,所以可用用无水硫酸铜检验c的反应产物中有没有水生成,如硫酸铜不变蓝,说明没有水生成,则说明过氧化氢中不含配位键,否则含有配位键,
故答案为:用无水硫酸铜检验c的反应产物中有没有水生成.
点评 本题考查我们对物质结构理论知识的掌握情况,题目以配位键作为信息考查学生的思维能力,要求我们通过阅读文字分析出配位键形成的实质,涉及的知识点有CO2、H3O+、CH4、H2SO4等物质的结构,以及对H3BO3电离的分析,注意硼原子为缺电子原子,H3BO3的电离是B原子和水电离的OH-形成配位键,水电离的H+表现酸性,题目难度中等.


 培优三好生系列答案
培优三好生系列答案 优化作业上海科技文献出版社系列答案
优化作业上海科技文献出版社系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 太阳能电池板材料除单晶硅外,还有铜、铟、镓、硒等化学物质.
太阳能电池板材料除单晶硅外,还有铜、铟、镓、硒等化学物质.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
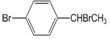 .写出该两步反应所需的试剂及条件:液溴、溴化铁作催化剂,溴、光照
.写出该两步反应所需的试剂及条件:液溴、溴化铁作催化剂,溴、光照 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 它们都含有 92个中子 | B. | ${\;}_{92}^{235}$U原子核外有143个电子 | ||
| C. | 它们是同种核素 | D. | 它们互为同位素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 能发生银镜反应的有机物一定属于醛类 | |
| B. | 乙烯和聚乙烯互为同系物 | |
| C. | 室温下,乙醇在水中的溶解度大于溴乙烷 | |
| D. | 乙醇与乙醚互为同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓硫酸在酯化反应中只起催化剂作用 | |
| B. | 甲烷、苯、乙醇、乙酸和乙酸乙酯在一定条件下都能发生取代反应 | |
| C. | 利用乙酸乙酯和乙醇的密度不同,可用分液的方法分离 | |
| D. | 烯烃能被酸性高锰酸钾溶液氧化,而苯的同系物不能 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该溶液中:c(OH-)>c(Na+)>c(SO32-)>c(HSO3-)>c(H+) | |
| B. | 该溶液中:c(Na+)+c(H+)═c(OH-)+2c(SO32-) | |
| C. | 该溶液的溶质为Na2SO3和NaHSO3 | |
| D. | 该溶液pH约为10的原因是NaOH过量 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com