
����Ŀ��һ���¶�ѹǿ�£����ݻ��ɱ���ܱ������з�����ӦCO(g)+H2O(g)![]() CO2(g)+H2(g) ��H��0��������˵������ȷ����
CO2(g)+H2(g) ��H��0��������˵������ȷ����
A.�����������䣬�Ӵ����벻�Ӵ�������H ��ͬ
B.���ﵽƽ�⣬����ϵ�г���CO2��ƽ�������ƶ�
C.�����ϸ÷�Ӧ����Ƴ�ȼ�ϵ�أ�H2O(g)�������Ϸ�����ԭ��Ӧ
D.ƽ��������ͨ��NaOH��Һǡ�÷�Ӧ�������¶���Һ������ǿ����pHһ������
���𰸡�D
��������
A.����ֻ�ı䷴Ӧ�Ŀ��������ܸı䷴Ӧ����ЧӦ��A�ԣ���ѡ��
B.���ﵽƽ��ʱ������ϵ�г���CO2���������Ũ������ƽ�������ƶ���B�ԣ���ѡ��
C.�÷�Ӧ��������ԭ��Ӧ��������Ƴ�ԭ��أ�H2O(g)��H�Ļ��ϼ۽��ͣ���H2O(g)�������Ϸ�����ԭ��Ӧ��C�ԣ���ѡ��
D.ƽ��������ͨ��NaOH��Һǡ�÷�Ӧ����Na2CO3��Na2CO3ˮ����Һ�Լ��ԣ������¶ȷ����˸ı䣬��Һ������ǿ����pH��һ������D����ѡD��
�ʴ�ѡD��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ͭ���仯�����ڹ�ũҵ������Ӧ�ù㷺��
��1���ڳ�ʪ�����У����������绯ѧ��ʴת��ΪFe(OH)2�ķ�Ӧ����ʽΪ_______���ں��е�Ũ��������Һ������װ���У�����ʴ�������ɿ쵽����˳����____________���������д����
��2����֪����3Fe��s��+2O2��g��=Fe3O4��s��![]() H=-1118 kJ��mol-1
H=-1118 kJ��mol-1
��2Al��s��+3/2O2��g��=A12O3��s��![]() H=-1675.7 kJ��mol-1
H=-1675.7 kJ��mol-1
�Ӹֹ�ʱ����Fe3O4������Ӧ��������Al2O3���Ȼ�ѧ����ʽΪ______________��
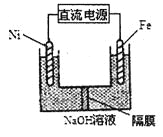
��3��Na2FeO4����ǿ�����ԣ������Ʒ���ͼ��ʾ����д�������ĵ缫��Ӧʽ______��Na2FeO4��һ�ּ���ɱ��������������������ˮ��ˮ����������ԭ����______________��
��4����ҵ�ϳ���FeCl3��Һ��ʴӡˢ��·�壬������Ӧ�����ӷ���ʽ��____________������ʴͭ������Һ�У�Cu2+��Fe3+��Fe2+Ũ�Ⱦ�Ϊ0��1 mol��L-1�������ͼ�������������Һ��ͨ�백��������Һ��pH=5��6ʱ����Һ�д��ڵĽ���������Ϊ____����ͼ�����ݼ���Fe(OH)2���ܶȻ�Ksp[Fe(OH)2]=______��
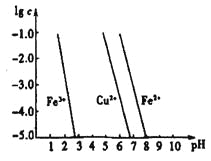
��֪��������Ϊ��Һ��pH��������Ϊ�������ӵ����ʵ���Ũ�ȵĶ���������Һ�н�������Ũ��![]() 10-5mol��L-1ʱ������Ϊ������ȫ����
10-5mol��L-1ʱ������Ϊ������ȫ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������β���к���CO��NO���к����塣
��1������β����NO���ɹ��̵������仯��ͼʾ��1molN2��1molO2��ȫ��Ӧ����NO��____�����������������ų�����____kJ������

��2��ͨ��NO�������ɼ������β����NO�ĺ������乤��ԭ����ͼ��ʾ������ʾ��O2-���ڴ˹��������������ƶ���

��NiO�缫�Ϸ�������___________��Ӧ������������������ԭ������
�����·�У������Ǵ�_________�缫����������NiO������Pt������
��Pt�缫�ϵĵ缫��ӦʽΪ________________________��
��3��һ�����ʹ�������NO��CO�ķ�Ӧ��2NO+2CO![]() 2CO2+N2����֪��������ıȱ��������߸÷�Ӧ���ʣ�Ϊ����֤�¶ȡ������ıȱ�����Ի�ѧ��Ӧ���ʵ�Ӱ����ɣ�ijͬѧ���������ʵ�飬���������Ѿ������±��С�
2CO2+N2����֪��������ıȱ��������߸÷�Ӧ���ʣ�Ϊ����֤�¶ȡ������ıȱ�����Ի�ѧ��Ӧ���ʵ�Ӱ����ɣ�ijͬѧ���������ʵ�飬���������Ѿ������±��С�
ʵ���� | t���棩 | NO��ʼŨ�� ��mol/L�� | CO��ʼŨ�ȣ�mol/L�� | �����ıȱ������m2/g�� |
�� | 280 | 1.2��10��3 | 5.80��10��3 | 82 |
�� | 280 | 1.2��10��3 | b | 124 |
�� | 350 | a | 5.80��10��3 | 82 |
���뽫�������ݲ���������a ___________��
������֤�¶ȶԻ�ѧ��Ӧ���ʹ��ɵ���ʵ��____________����ʵ����ţ���
��ʵ����ʵ����У�NO�����ʵ���Ũ��c��NO����ʱ��t�ı仯������ͼ��ʾ�����б�ʾʵ����������_______����������������������

��4�����ݻ��̶��ľ��������з�����Ӧ2NO+2CO2CO2+N2������˵���Ѵﵽƽ��״̬����________��������ѡ��
A�������ڻ�������¶Ȳ��ٱ仯 B�������ڵ�����ѹǿ���ֲ���
C��2����(NO)=����(N2) D�������ڻ�������ܶȱ��ֲ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾ���ܸ�AB���˷ֱ���������ͬ��������ͬ�Ŀ���ͭ��Ϳ��������ڸܸ�ʹ����ˮ�б���ƽ�⣬Ȼ��С�ĵ����ձ��������ŨCuSO4��Һ��һ��ʱ��������йظܸ˵�ƫ���ж���ȷ����(ʵ������в�������˿��Ӧ�����߸����ı仯) �� ��
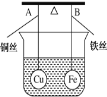
A. �ܸ�Ϊ����;�Ե��ʱ����ΪA�˸�B�˵�
B. �ܸ�Ϊ����;�Ե��ʱ����ΪA�˵�B�˸�
C. ���ܸ�Ϊ��Ե��ʱ��A�˵�B�˸ߣ�Ϊ����ʱ��A�˸�B�˵�
D. ���ܸ�Ϊ��Ե��ʱ��A�˸�B�˵ͣ�Ϊ����ʱ��A�˵�B�˸�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�л���ṹ��ʽΪ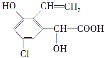 �����й��ڸ��л����˵���в���ȷ����
�����й��ڸ��л����˵���в���ȷ����
A. ��FeCl3��Һ����ɫ
B. ������������������Һ��һ�������·�Ӧ���������NaOH 3 mol
C. �ܷ������۷�Ӧ�ͼӾ۷�Ӧ
D. 1 mol���л�����Ũ��ˮ��Ӧ���������3 mol Br2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����¡���ѹ�£�1molA��1molB��һ���ݻ��ɱ�������з�����Ӧ��A(g)+2B(g)![]() 2C(g)��һ��ʱ���ﵽƽ�⣬����amolC������˵������ȷ���ǣ� ��
2C(g)��һ��ʱ���ﵽƽ�⣬����amolC������˵������ȷ���ǣ� ��
A.��ʼʱ�ʹﵽƽ��ʱ�����е�ѹǿ֮��Ϊ1��1
B.ƽ��ʱ����A��B��ת����֮��Ϊ1��2
C.ƽ��ʱA��ת����Ϊ![]()
D.��v��(A)=v��(B)ʱ�����ж���Ӧ�ﵽƽ��״̬
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ҹ������������Ĵ�����ӣ���������������˺ܴ����Ⱦ������β��װ��������ڴ�������������������õĹ�����ͼ��ʾ������˵����ȷ���ǣ� ��

A. ��Ӧ��NOΪ��������N2Ϊ��������
B. ����β������Ҫ��Ⱦ�ɷְ���CO��NO��N2
C. NO��O2�����ڴ���������ܷ�Ӧ
D. ��ת���ܻ�ѧ����ʽΪ2NO��O2��4CO ![]() 4CO2��N2
4CO2��N2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҽ�伮�����������������ű���ķ���������һ�գ���ˮ�����գ���ȡ֭������֮���� ���������Ŷ��з�����ű������Чҩ�����������о����ʾ���á��������ڶԱ�ʵ���з��ֹŷ���Ч���£�����Ƶ���ȡ�����صĹ��տ��Լ��������̣�
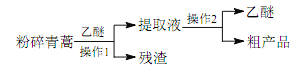
����������Ϣ�����������жϻ������п϶��������
A. ����Ȼֲ������ȡ��Ч�ɷ����Ƽ�����ҩ���з�����Ҫ;��
B. �����������������Ч�ɷֵ���ȡ��
C. ������������ˮ������
D. ���� 1 �ǹ��ˣ����� 2 ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��25��ʱ��Ag2CrO4�ڲ�ͬŨ��CrO42-��Һ�е��ܽ����ͼ��ʾ������˵����ȷ����![]()
![]()
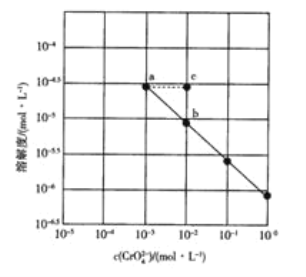
A.ͼ��a��b����c(Ag+)��ͬ
B.ͼ��a��Ag2CrO4���ܶȻ���b��Ĵ�
C.��a������Һ�м���������AgNO3���ܽ�ȿɱ�Ϊc��
D.���¶��£�Ag2CrO4�ܶȻ���������Ϊ10-12
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com