
�״���һ�ֿ�������Դ�����й㷺�Ŀ�����Ӧ��ǰ����
(1) ��ҵ��һ������������ַ�Ӧ�ϳɼ״���
��Ӧ��CO (g)��2H2(g) CH3OH(g)����H1
CH3OH(g)����H1
��Ӧ��CO2(g)��3H2(g) CH3OH(g)��H2O(g)����H2
CH3OH(g)��H2O(g)����H2
��������Ӧ���ϡ�ԭ�Ӿ��á�ԭ�����________(���)��
���±����������Ƿ�Ӧ���ڲ�ͬ�¶��µĻ�ѧƽ�ⳣ��(K)��
| �¶� | 250 �� | 300 �� | 350 �� |
| K | 2.041 | 0.270 | 0.012 |
�ɱ��������жϣ���H1______0(�����������������)��
��ij�¶��£���2 mol CO��6 mol H2����2 L���ܱ������У���ַ�Ӧ���ﵽƽ����c(CO)��0.2 mol·L��1����CO��ת����Ϊ________����ʱ���¶�Ϊ________(���ϱ���ѡ��)��
(2)���и�������Ϊ�жϷ�Ӧ����2 L���ܱ������дﵽ��ѧƽ��״̬�����ݵ�
��_______���������ĸ����
A��������CO��H2��CH3OH��Ũ��֮��Ϊ1��2��1
B��2v(H2)(��) �� v(CO)(��)
C��������ѹǿ���ֲ���
D�����������ܶȱ��ֲ���
(3)��֪�ڳ��³�ѹ�£�
��2CH3OH(l)��3O2(g)===2CO2(g)��4H2O(g) ��H1����1 275.6 kJ·mol��1
��2CO(g)��O2(g)===2CO2(g) ��H2����566.0 kJ·mol��1
��H2O(g)===H2O(l)����H3����44.0 kJ·mol��1
д���״�����ȫȼ������һ����̼��Һ̬ˮ���Ȼ�ѧ����ʽ��
 ��ĩ���䵥Ԫ�����ิϰ��ϵ�д�
��ĩ���䵥Ԫ�����ิϰ��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
A��B��C��D���ֶ�����Ԫ�أ�ԭ��������������A��Dͬ�壬B��Cͬ���ڡ�A��B��ɵĻ������Ϊ��̬������A��B��ԭ����֮��Ϊ4��1����A��C��ɵ����ֻ������ҡ�������Һ̬������A��Cԭ ����֮��Ϊ1��1������A��Cԭ����֮��Ϊ2��1����D��C��ɵ����ֻ����ﶡ���춼�ǹ��壬����D��Cԭ����֮��Ϊ1��1������D��Cԭ����֮��Ϊ2��1��д���������ʵĻ�ѧʽ����____________����____________����____________����____________����____________��
����֮��Ϊ1��1������A��Cԭ����֮��Ϊ2��1����D��C��ɵ����ֻ����ﶡ���춼�ǹ��壬����D��Cԭ����֮��Ϊ1��1������D��Cԭ����֮��Ϊ2��1��д���������ʵĻ�ѧʽ����____________����____________����____________����____________����____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
������Һ�е�Cl�������ʵ�����50 mL 1 mol ��L��1 MgCl2��Һ����ȵ���
A��150 mL 1 mol��L��1��NaCl��Һ �� B��75 mL 0.5mol��L��1��CaCl2��Һ
C��50 mL 2 mol��L��1��KCl��Һ ���� D��75 mL 1 mol ��L��1��FeCl3��Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��ָ���������£����и��������ܴ���������ǣ� ����
A��ʹ���ȱ�����Һ�У�Fe2+��Na����I����NH4+
B��ǿ������Һ�У�K����Na����ClO����S2��
C��0.1 mol·L��1 NaAlO2��Һ�У�H����Na����Cl����SO42��
D����H2O�������c(H+)=10-11mol/L��Һ�У�Na����HCO3����AlO2����SO42��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
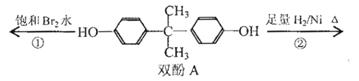
˫��A��ΪʳƷ�����ϰ�װ����ƿ��������Ʒ�����Ӽ����ܵ��������ڷ���ʧ��,�Զ�ͯ�Ľ���Σ�����������й�˫��A����������ȷ���ǣ� ��
A��˫��A�ķ���ʽ��C15H16O2
B��˫��A�ĺ˴Ź���������ʾ��ԭ����֮����1:2:2:3
C����Ӧ���У�1mol˫��A�������2 mol Br2
D����Ӧ�ڵIJ�����ֻ��һ�ֹ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
���˽��齫��Ԫ������Ԫ�����ڱ��ĵڢ�A�塣������ʵ��֧����һ�۵����(����)
����ԭ�ӵõ�һ�����Ӻ��������Ӵﵽ�ȶ��ṹ ������ӵĽṹʽΪH—H��
��������Ԫ���γ����ӻ�����M+[��H]-�� �ܷ�����ԭ�Ӽ�Ļ�ѧ�������ڷǼ��Լ�
A���٢ڢ� B���٢ۢ� C���ڢۢ� D���٢ڢۢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����˵����ȷ����
A��ԭ�ӵĵ��Ӳ���Խ�࣬ԭ�Ӱ뾶Խ��
B��ͬ��Ԫ������ԭ����������Ϊ16��26��36��46
C����A�����A��Ԫ�ؼ���γɹ��ۻ���������ӻ�����
D��±��Ԫ�صĵ��ʾ��������ԣ�������۶��ǣ�7
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��ʵ�����У��������¹ʻ�ҩƷ�Ĵ�����ȷ����
A���д���������й©ʱ���÷���ˮ��ʪ�������棬��Ѹ���뿪�ֳ�
B���������Ż�ȼ��ʱ������ĭ��������
C������Ũ����մ��Ƥ���ϣ�����������������Һ��ϴ
D��������ķ�Һ����ˮ�ۣ���ˮ������ˮ��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com