
【题目】下列物质中导电性能最差的是( )
A.石墨棒
B.固体氧化钾
C.盐酸
D.熔融氢氧化钠
 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案科目:高中化学 来源: 题型:
【题目】关于下列装置说法正确的是( ) 
A.装置①中,盐桥中的K+移向ZnSO4溶液
B.装置②工作一段时间后,a极附近溶液的pH增大
C.用装置③精炼铜时,c极为粗铜
D.装置④中电子由Zn流向Fe,装置中有Fe2+生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】使用微波炉加热,具有使受热物质均匀受热、表里一致、速度快、热效率高等优点。其工作原理是通电后炉内的微波场以几亿赫兹的高频改变外电场的方向,水分子因而能迅速摆动,产生热效应,这是因为( )
A. 水分子具有极性共价键 B. 水分子是极性分子
C. 水由氢、氧两元素组成 D. 水分子中有共用电子对
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒温恒容的密闭容器中,充入4mol气体A和2mol气体B发生反应:3A(g)+2B(g)4C(?)+2D(?).反应一段时间后达到平衡,测得生成1.6mol C,反应前后体系压强之比为5:4.则下列说法正确的是( )
A.气体A的平衡转化率大于气体B的平衡转化率
B.物质D的聚集状态一定是气体
C.平衡后升高温度,若平衡向左移动,则正反应的△H>0
D.平衡后若减小该体系的压强,则平衡向左移动,化学平衡常数增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钒是一种熔点高、硬度大、无磁性的金属,广泛应用于钢铁、航空航天、能源、化工等领域。目前工业上使用一种新工艺,以便从冶炼铝的固体废料一赤泥中提取金属钒,赤泥主要含有Fe2O3、Al2O3、V2O5和CuO,具体工艺流程图如下:

已知:钒有多种价态,其中+5价最稳定。钒在溶液中主要以VO2+和VO3-的形式存在,且存在平衡VO2++H2O![]() VO3-+2H+。回答下列问题:
VO3-+2H+。回答下列问题:
(1)磁性产品的化学式为_________________________。
(2)赤泥加入NaOH溶液,发生的离子反应方程式为___________________。能否用氨水代替NaOH溶液,___________(填“能”或“不能”),理由是___________________________________________。
(3)滤液1生成沉淀的离子反应方程式为_________________________________________。
(4)调至pH=8的目的有两个,一是___________________,二是使VO2+转化为VO3-,此时溶液中VO2+和VO3-的物质的量之比为a:b,VO2++H2O![]() VO3-+2H+的平衡常数K=____________________。
VO3-+2H+的平衡常数K=____________________。
(5)滤液2加氯化铵生成NH4VO3的离子方程式为__________________________,该反应能发生是因为__________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学课题小组将二氧化硫的制备与多个性质实验进行了一体化设计,实验装置如图所示。下列说法不正确的是
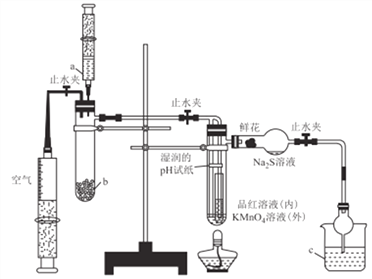
A. a、b、c中依次盛装70%硫酸.Na2SO3固体、NaOH溶液
B. 实验时,湿润的pH试纸、鲜花、品红溶液、KMnO4溶液均褪色,Na2S溶液出现淡黄色沉淀
C. 此设计可证明SO2水溶液的酸性,SO2的氧化性、还原性、漂白性
D. 点燃酒精灯加热,可证明SO2使品红溶液褪色具有可逆性,使KMnO4溶液褪色不具有可逆性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应速率是描述化学反应进行快慢程度的物理量。某学生为了探究镁条与盐酸反应过程中反应速率的变化,利用如图装置测定一定时间内反应放出氢气的体积(加入稀盐酸的体积为100mL.忽略反应中溶液体积的变化),实验记录如下表(累计值):

时间(min) | l | 2 | 3 | 4 | 5 | 6 |
氢气体积(mL)(标准状况) | 1 | 50 | 120 | 232 | 288 | 310 |
(1)除如图所示的实验用品外,还需要的一件实验仪器是_________。
(2)实验前,检查该装置气密性的方法是_________。
(3)装置气密性良好,0~lmin时间段氢气体积却很少的原因是_________。
(4)反应速率最大的时间段是_________min(填“0~1”1~2”2~3”3~4”“4~5”或“5~6”),原因是_________(从影响反应速率因素的角度解释)。
(5)3~4min时间段,以盐酸的浓度变化来表示的该反应速率为_________(设溶液体积不变)。
(6)由于反应太快,测量氢气体积时不好控制,他就事先在盐酸溶液中分别加入等体积的下列液体以减慢反应速率,你认为不可行的是_________(填相应字母)。
A.蒸馏水 B.KCl溶液 C.KNO3溶液 D.CuSO4溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com