
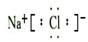 .
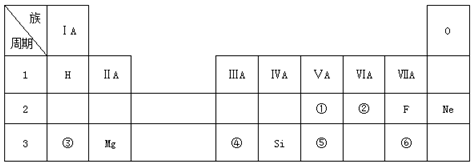
.分析 由元素在周期表中的位置知,①②③④⑤⑥分别是N、O、Na、Al、P、Cl元素,
(1)②位于第二周期第ⅥA族,是氧元素;
(2)根据元素在周期表中的位置可以确定①⑤分别为N、P,同主族自上而下原子半径逐渐增大;
(3)同周期自左而右元素金属性减弱;
(4)根据元素在周期表中的位置可以确定③⑥分别为Na、Cl,形成的化合物是离子化合物NaCl;
(5)元素的金属性越强,对应的最高价氧化物的水化物的碱性越强.
解答 解:由元素在周期表中的位置知,①②③④⑤⑥分别是N、O、Na、Al、P、Cl元素,
(1)②表示O元素,故答案为:O;
(2)同主族自上而下原子半径增大,故原子半径①<⑤,故答案为:<;
(3)同周期自左而右元素金属性减弱,故金属性:③>④,故答案为:>;
(4)③位于第三周期第ⅠA族,是Na元素,⑥位于第三周期第ⅦA族,是Cl元素,形成的化合物是离子化合物NaCl,电子式为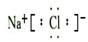 ,
,
故答案为: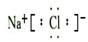 ;
;
(5)金属性:③>④,元素的金属性越强,对应的最高价氧化物的水化物的碱性越强,故答案为:NaOH.
点评 本题考查元素周期表的结构和元素周期律综合应用,为高考常见题型,通过元素在周期表中的位置确定是何种元素是解题的关键,试题比较基础,难度中等.


 优等生题库系列答案
优等生题库系列答案科目:高中化学 来源: 题型:解答题
| 时间(min) | 0 | 5 | 10 | 15 | 20 |
| c(CO2)(mol/L) | 0.00 | 0.02 | 0.03 | 0.03 | 0.03 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用物质A表示的平均反应速率为0.3mol/(L•s) | |
| B. | 用物质B表示的平均反应速率为0.6mol/(L•s) | |
| C. | 2 s时物质A的转化率为70% | |
| D. | 2 s时物质B的浓度为0.5mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用水鉴别甲酸、乙醛、乙酸 | |
| B. | 除去乙烷中少量的乙烯:光照条件下通入氢气 | |
| C. | 除去乙醇中少量的乙酸:加入足量的生石灰,过滤 | |
| D. | 用燃烧的方法鉴别乙醇、苯和四氯化碳 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 精炼时粗铜接电源负极 | |
| B. | 精炼时纯铜作阴极 | |
| C. | 杂质都将以单质形式沉积到池底 | |
| D. | 纯铜片增重2.56 g,电路中通过电子为0.04 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SiO2和CO2一样能够与NaOH溶液反应 | |
| B. | 硅的导电性能介于金属和绝缘体之间,是良好的半导体材料 | |
| C. | 硅酸是一种比碳酸还弱的酸 | |
| D. | 硅的化学性质不活泼,常温下不与任何物质反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | +4 | B. | +3 | C. | +2 | D. | +1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com