
【题目】氨基甲酸铵(NH2COONH4)是一种白色固体,可由两种常见气体制取,其易分解、易水解,可用于医药、氨化剂等。某科研小组利用以下装置制备氨基甲酸铵。回答下列问题:
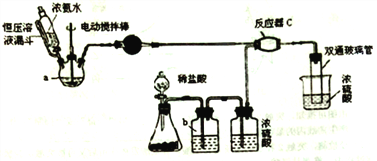
(1)写出a中的固体药品的名称________,制取氨气的原理为___________(结合化学方程式并用简要的文字加以说明)。
(2)恒压滴液漏斗的作用是________。
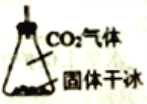
(3)有同学建议该CO2发生装置直接改用如下装置代替,你认为他的改进有何优点(试述一种): ________ 。
(4)反应器C中发生反应的化学方程式为________ 。
(5) 双通玻璃管的作用________;b中溶液的作用________ 。
(6)上述制得的氨基甲酸铵可能含有碳酸氢铵、碳酸铵中的一种或两种。
①设计方案,进行成分探究,请填写表中空格。
限选试剂: 蒸馏水、稀HNO3、BaCl2溶液、Ba(OH)2溶液、AgNO3溶液、稀盐酸。
实验步骤
预期现象和结论
步骤1: 取少量固体样品于试管中,加入蒸馏水至固体溶解。
得到无色溶液
步骤2: 向试管中加入过量的BaCl2溶液,静置。
溶液不变浑浊,则证明固体中不含有________。
步骤3: 取步骤2的上层清液于试管中加入少量 的______。
溶液变浑浊,则证明固体中含有_______。
②根据①的结论: 取氨基甲酸铵样品15.80g,用上题步骤经充分处理后,过滤、洗涤、干燥,测得沉淀质量为5.91g 。则样品中氨基甲酸铵的质量分数为________。
【答案】 新制生石灰(NaOH固体、碱石灰均可) CaO+NH3.H2O=Ca(OH)2+NH3↑ CaO吸水且放热促进氨气生成 平衡压强,使漏斗内液体顺利滴下 装置简单,无需干燥;②低温环境,提高产率(答其中一点即可) 2NH3+CO2=H2NCOONH4 防止倒吸 吸收氯化氢气体 (NH4)2CO3 Ba(OH)2 NH4HCO3 85.0%(0.85)
【解析】由题意结合实验装置可得,三颈烧瓶中产生氨气,锥形瓶中产生CO2,经除杂干燥后的氨气和CO2在反应器C中反应生成氨基甲酸铵。
(1)恒压滴液漏斗盛有浓氨水,是利用NH3H2O受热分解产生氨气,所以a中的固体药品可以是新制生石灰(或氢氧化钠固体、碱石灰等);生石灰主要成分为CaO,滴入氨水发生反应:CaO+NH3H2O=Ca(OH)2+NH3↑,CaO吸水且放热促进氨气生成。
(2)a中产生气体,使压强增大,使用恒压滴液漏斗可以平衡漏斗与三颈烧瓶中的压强,使漏斗内液体顺利滴下。
(3)原装置,用稀盐酸与碳酸钙制取二氧化碳,需要除去HCl气体,因为氨基甲酸铵易分解、易水解,所以需要干燥,并且稀盐酸与碳酸钙的反应放热,会降低氨基甲酸铵的产率,替代装置,具备如下优点:①装置简单,无需干燥;②低温环境,提高产率等。
(4)氨气和CO2在反应器C中反应生成氨基甲酸铵,根据原子守恒,化学方程式为:2NH3+CO2=H2NCOONH4。
(5)右侧烧杯中浓硫酸的作用是:①防止C中生成的氨基甲酸铵与空气中的水蒸气接触而水解,②吸收剩余的氨气,所以双通玻璃管的作用是防止倒吸;锥形瓶中用稀盐酸与碳酸钙制取二氧化碳,二氧化碳中会有氯化氢气体,所以b的作用是吸收氯化氢气体。
(6)①碳酸铵能与BaCl2溶液反应生成BaCO3沉淀,碳酸氢铵与BaCl2溶液不反应,所以步骤2中溶液不变浑浊,则证明固体中不含(NH4)2CO3;碳酸氢铵能与Ba(OH)2溶液反应生成BaCO3沉淀,所以步骤3中加入的试剂可以是Ba(OH)2,溶液变浑浊,则证明固体中含有NH4HCO3。②由题意,氨基甲酸铵样品15.80g,BaCO3沉淀的质量为5.91g,根据碳原子守恒,n[(NH4)2CO3]=n(BaCO3)=5.91g÷197g/mol=0.03mol,m[(NH4)2CO3]=0.03mol×79g/mol=2.37g,所以样品中氨基甲酸铵的质量分数为:(15.80g-2.37g)÷15.80g×100%=85.0%。


科目:高中化学 来源: 题型:
【题目】用密度为1.84 g/mL,质量分数为98%的浓硫酸配制480 mL 0.1 mol/L 稀硫酸。
(1)所需浓硫酸的体积是__________。
(2)配制过程需要的玻璃仪器有量筒、烧杯、玻璃棒、________、_________。
(3)配制溶液时,一般可以分为以下几个步骤:
①量取②计算③稀释④摇匀⑤移液⑥洗涤⑦定容⑧冷却⑨初步振荡⑩装瓶贴签
其正确的操作顺序为 ______(填序号)。
(4)第⑦步实验的操作是__________________。
(5)下列情况对所配制的稀硫酸浓度有何影响?(用字母填写a.“偏大” b.“偏小” c.“无影响”)
A.所用的浓硫酸长时间放置在密封不好的容器中_______;
B.容量瓶用蒸馏洗涤后残留有少量的水_________;
C.定容摇匀后,发现液面低于刻度线,又用胶头滴管加蒸馏水至刻度线_________;
D.量取浓硫酸时仰视量筒上的刻度取用浓硫酸_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了测定某有机物A的结构,设计如下实验:
①将2.3g该有机物完全燃烧,测得生成0.1molCO2和2.7g 水;
②用质谱仪测定其相对分子质量,得到如图所示的质谱图;
③用核磁共振仪处理该化合物,得到如下图所示核磁共振氢谱,图中三个峰的面积之比是1∶2∶3。
试回答下列问题:


(1)有机物A的相对分子质量是____。
(2)有机物A的实验式是____。
(3)____(填“能”或“不能”)根据A的实验式确实A的分子式,若能,说明原因___。
(4)某有机化合物A在足量的氧气中完全燃烧只生成CO2和H2O,同温同压下,其蒸气对氢气的相对密度为37。用元素分析仪分析得知,A分子中含碳、氢的质量分数分别为64.9%和13.5%,则A的分子式_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】需要配制500 mL 0.5 mol·L-1氢氧化钠溶液,经测定实际所配氢氧化钠溶液的浓度为0.45 mol·L-1。可能的原因是( )
A. 转移时溶液没有冷却至室温 B. 容量瓶没有烘干
C. 称量氢氧化钠固体时砝码放反了 D. 定容时仰视读数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的数值,下列说法正确的是( )
A. 常温常压下,8 g O2含有4NA个电子
B. 1 L 0.1 mol·L-1的氨水中有0.1NA个NH4+
C. 标准状况下,22.4 L盐酸含有NA个HCl分子
D. 0.05 mol液态KHSO4中含有0.1NA个阳离子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关氢氰酸![]() 的下列性质中,不能证明它是弱电解质的是( )
的下列性质中,不能证明它是弱电解质的是( )
A. ![]() 氢氰酸溶液的pH约为4
氢氰酸溶液的pH约为4
B. 常温下,![]() a的HCN稀释100倍后所得溶液
a的HCN稀释100倍后所得溶液![]() a
a![]()
C. KCN溶液呈碱性
D. ![]() 恰好与
恰好与![]() 溶液完全反应
溶液完全反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸锌可作为食品锌强化剂的原料。工业上常用菱锌矿生产硫酸锌,菱锌矿的主要成分是![]() ,并含少量的
,并含少量的![]() 、
、![]() 、MgO、CaO等,生产工艺流程图如下:
、MgO、CaO等,生产工艺流程图如下:
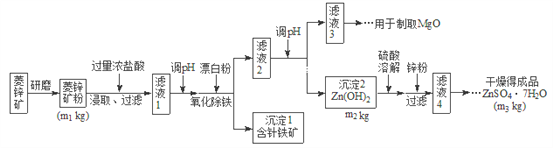
(1)将菱锌矿研磨成粉的目的是_______________。
(2)写出Fe3+水解的离子方程式_________________。
(3)根据下表数据,调节“滤液2”的pH时,理论上可选用的最大区间为__________。
沉淀化学式 |
|
|
|
|
开始沉淀的pH |
|
|
|
|
沉淀完全的pH |
|
|
|
|
开始溶解的pH |
|
|
|
|
Ksp |
|
|
|
|
(4)工业上从“滤液3”制取MgO过程中,合适的反应物是________选填序号。
![]() 大理石粉
大理石粉 ![]() 石灰乳 c纯碱溶液 d氨水
石灰乳 c纯碱溶液 d氨水
(5)“滤液4”之后的操作依次为________、_______、过滤,洗涤,干燥。
(6)分析图中数据,菱锌矿粉中![]() 的质量分数不低于__________用代数式表示
的质量分数不低于__________用代数式表示
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com