
【题目】Ba(NO3)2可用于生产烟花。某主要生产BaCl2、BaCO3、BaSO4的化工厂利用某种钡泥[主要含有BaCO3、Ba(FeO2)2、极少量CuCO3等]制取Ba(NO3)2晶体,其部分工艺流程如下:

已知:Fe3+和Fe2+以氢氧化物形式沉淀完全时,溶液的pH分别为3.2和9.7。
(1)酸溶时不使用浓硝酸的原因是_________________________________。
(2)酸溶后溶液中pH=1,Ba(FeO2)2与HNO3的反应化学方程式为__________________。
(3)该厂结合本厂实际,中和选用的X为____________(填化学式);中和使溶液中______(填离子符号)的浓度减少(中和引起的溶液体积变化可忽略)。
(4)滤液得到Ba(NO3)2晶体的操作依次为_________、_________、过滤。
(5)该厂生产的Ba(NO3)2晶体含有少量Cu2+。化学上通过惰性电极电解法富集Cu时,发现电解装置的阴极还有少量使红色石蕊试纸变蓝的气体生成。生成该气体的电极反应为______________________________。
(6)Ba2+致死量为355mg/kg。误食Ba2+可以服用MgSO4溶液解毒,涉及到的离子反应方程式为___________;为了减少环境污染,请对上述流程中不合理的设计进行改进,改进措施是__________________。
【答案】浓HNO3易挥发、分解 Ba(FeO2)2+8HNO3=Ba(NO3)2+2Fe(NO3)3+4H2O BaCO3 Fe3+、H+ 蒸发浓缩 冷却结晶 NO3-+ 6H2O +8e-=NH3 ↑+ 9OH- Ba2+ + SO42- = BaSO4 ↓ 洗涤废渣并回收洗涤液
【解析】
BaCO3含少量CuCO3、Ba(FeO2)2等杂质,其中Ba(FeO2)2中钡元素为+2价,铁元素为+3价,加入硝酸,在容器中充分溶解得到溶液,此溶液中含有钡离子、铜离子、三价铁离子,可加入X碳酸钡,调节溶液pH=4~5,使铁离子、铜离子水解生成Fe(OH)3沉淀、Cu(OH)2沉淀,过滤后废渣为Fe(OH)3、Cu(OH)2,滤液中主要含有硝酸、硝酸钡,经蒸发浓缩,冷却结晶,过滤可得到硝酸钡晶体,据此分析解答。
BaCO3含少量CuCO3、Ba(FeO2)2等杂质,其中Ba(FeO2)2中钡元素为+2价,铁元素为+3价,加入硝酸,在容器中充分溶解得到溶液,此溶液中含有钡离子、铜离子、三价铁离子,可加入X碳酸钡,调节溶液pH=4~5,使铁离子、铜离子水解生成Fe(OH)3沉淀、Cu(OH)2沉淀,过滤后废渣为Fe(OH)3、Cu(OH)2,滤液中主要含有硝酸、硝酸钡,经蒸发浓缩,冷却结晶,过滤可得到硝酸钡晶体。
(1)酸溶时不使用浓硝酸的原因是浓HNO3易挥发、分解;
(2)酸溶后溶液中pH=1,Ba(FeO2)2与HNO3反应生成硝酸钡、硝酸铁和水,反应的化学方程式为Ba(FeO2)2+8HNO3=Ba(NO3)2+2Fe(NO3)3+4H2O;
(3)该厂结合本厂实际,中和选用的X必须能消耗过量硝酸并使铁离子沉淀而除去,且不引入新的杂质,可为BaCO3;中和使溶液中Fe3+、H+的浓度减少;
(4)滤液得到Ba(NO3)2晶体的操作依次为蒸发浓缩、冷却结晶、过滤;
(5)电解装置的阴极还有少量使红色石蕊试纸变蓝的气体生成,则气体显碱性为氨气,生成该气体的电极反应是硝酸根离子得电子产生氨气,电极反应式为NO3-+ 6H2O +8e-=NH3 ↑+ 9OH-;
(6)误食Ba2+可以服用MgSO4溶液解毒,钡离子与硫酸根离子反应产生难溶于酸的硫酸钡,涉及到的离子反应方程式为Ba2+ + SO42- = BaSO4 ↓;为了减少环境污染,请对上述流程中不合理的设计进行改进,改进措施是洗涤废渣并回收洗涤液,避免引起污染。


科目:高中化学 来源: 题型:
【题目】我国是世界铅生产和铅消费的最大国,而铅的冶炼方法具有成本高、污染严重等缺点。
I.铅的冶炼
一种用铅矿石(主要成分为PbS)冶炼铅的改进工艺流程如下图所示。

(1)浮选前将铅矿石破碎的目的是____________________
(2)反应器氧化段的主要反应有2PbS+3O2![]() 2PbO+2SO2(反应a)和PbS+2PbO
2PbO+2SO2(反应a)和PbS+2PbO![]() 3Pb+SO2(反应b),反应a中的氧化剂是_______(填化学式);反应b中氧化产物和还原产物的物质的量之比为____________。
3Pb+SO2(反应b),反应a中的氧化剂是_______(填化学式);反应b中氧化产物和还原产物的物质的量之比为____________。
(3)该工艺流程与传统方法相比优点之一就是可得到富SO2烟气,富SO2烟气可直接用于某种工业生产,请写出表示该工业生产的原理的化学方程式_________、________。
Ⅱ.含铅废水处理
化学沉淀法是除去酸性废水中Pb2+的主要方法,根据其原理不同可以分为:氢氧化物沉淀法、硫化物沉淀法、磷酸盐沉淀法、铁氧体沉淀法等。水溶液中各形态铅的百分含量x与溶液pH变化的关系如图所示。向含Pb2+的溶液中逐滴滴加NaOH,溶液变浑浊,继续滴加NaOH溶液又变澄清。

(4)若采用氢氧化物沉淀法除溶液中的Pb2+,应将溶液的pH调至约为______。pH![]() 13时,溶液中发生的主要反应的离子方程式为________________________。
13时,溶液中发生的主要反应的离子方程式为________________________。
(5)向酸性含铅废水中加Na2S可将Pb2+转化为PbS除去,使用该方法通常先将溶液pH调至6左右,若溶液pH过低会导致_____。已知Ksp (PbS) =8.0![]() 10-28,国家规定的废水排放标准中铅含量不高于0.5mg/L,若某工厂处理过的废水中S2-浓度为2.0
10-28,国家规定的废水排放标准中铅含量不高于0.5mg/L,若某工厂处理过的废水中S2-浓度为2.0![]() 10-20mol/L,该废水中铅含量_________ (填“已经”或“尚未”)达到国家规定的排放标准。
10-20mol/L,该废水中铅含量_________ (填“已经”或“尚未”)达到国家规定的排放标准。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钴、 铜及其化合物在工业上有重要用途, 回答下列问题:
(1) 请补充完基态Co的简化电子排布式: [Ar]_________, Co2+有_______个未成对电子。
(2) Na3[Co(NO2)6]常用作检验K+的试剂, 配位体NO2-的中心原子的杂化形式为________, 空间构型为_____。大π键可用符号![]() 表示, 其中m代表参与形成大π键的原子数, n为各原子的单电子数(形成σ键的电子除外)和得电子数的总和 (如苯分子中的大π键可表示为
表示, 其中m代表参与形成大π键的原子数, n为各原子的单电子数(形成σ键的电子除外)和得电子数的总和 (如苯分子中的大π键可表示为![]() ),则NO2-中大π键应表示为____________。
),则NO2-中大π键应表示为____________。
(3) 配合物[Cu(En)2]SO4的名称是硫酸二乙二胺合铜(Ⅱ), 是铜的一种重要化合物。其中 En 是乙二胺(H2NCH2CH2NH2)的简写。
①该配合物[Cu(En)2]SO4中N、 O、 Cu的第一电离能由小到大的顺序是______________。
②乙二胺和三甲胺[N(CH3)3]均属于胺, 且相对分子质量相近, 但乙二胺比三甲胺的沸点高得多, 原因是______________________________________________________。

(4) 金属Cu晶体中的原子堆积方式如图所示, 其配位数为______, 铜的原子半径为a nm, 阿伏加德罗常数的值为NA, Cu的密度为_________g/cm3(列出计算式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近年来,利用SRB(硫酸盐还原菌)治理废水中的有机物、SO42-及重金属污染取得了新的进展。
(1)下图表示H2CO3和H2S在水溶液中各种微粒物质的量分数随pH的变化曲线。某地下水样pH=8.5,在SRB的作用下,废水中的有机物(主要为CH3COO─)将SO42-还原为-2价硫的化合物,请用离子方程式表示该过程中的化学变化:_______________。
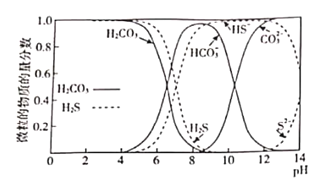
(2)SRB除去废水中有机物的同时,生成的H2S还能用于构造微生物电池,某pH下该微生物燃料电池的工作原理如下图所示。

①写出电池正极的电极反应:________________。
②负极室的pH随反应进行发生的变化:__________(“减小”或“增大”),结合电极反应解释pH变化的原因:__________。
(3)SRB可用于处理废水中含重金属锑(Sb)的离子。
①通过两步反应将Sb(OH)6-转化为Sb2S3除去,转化过程中有单质生成。完成第一步反应的离子方程式。
第一步: Sb(OH)6-+ H2S ===1 + 1 ↓+ H2O,_______________________
第二步:3H2S +2SbO2-+2H+ ===Sb2S3↓ +4H2O
②某小组模拟实验时配制amL含Sb元素b mg·L-1 的废水,需称取________gKSb(OH)6(相对分子质量为263)。提示:列出计算式即可。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒温恒容中反应:2NO2(g)![]() 2NO(g)+O2(g),能说明反应达平衡状态的是:
2NO(g)+O2(g),能说明反应达平衡状态的是:
①单位时间内生成n mol O2的同时生成2n mol NO2;
②单位时间内生成n mol O2 的同时生成2n mol NO;
③NO2、NO、O2 的反应速率的比为2 : 2 : 1的状态;
④混合气体的颜色不再改变的状态;
⑤混合气体的密度不再改变的状态;
⑥混合气体的平均相对分子质量不再改变的状态。
A. ①④⑥ B. ②③⑤ C. ①③④ D. 全部
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在2 L的密闭容器中,X、Y、Z三种气体的量随时间变化的曲线如图所示:

(1)从反应开始到10 s时,用Z表示的反应速率为 ,X的物质的量浓度减少了 ,Y的转化率为 。
(2)该反应的化学方程式为
(3)10 s后的某一时刻(t1)改变了外界条件,其速率随时间的变化图像如图所示:

则下列说法符合该图像的是 。
A.t1时刻,增大了X的浓度 B.t1时刻,升高了体系温度
C.t1时刻,缩小了容器体积 D.t1时刻,使用了催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高分子H是一种成膜良好的树脂,其合成路线如下:

已知:①A的相对分子质量为58,氧元素质量分数为0.276,核磁共振氢谱显示只有一组峰;
② ![]()
(1)A的结构简式为 ____________________________,G中官能团名称为_________________
(2)由B生成C的化学方程式为___________________________________________________。
(3)D的系统命名为_________________。
(4)化合物E的沸点 ______ (选填“>”,“<”或者“=”)2-甲基丙烷。
(5)F与新制Cu(OH)2悬浊液反应的化学方程式为____________________________________。
(6)H的结构简式为________________________________________。
(7) 的符合下列条件的同分异构体有____种
的符合下列条件的同分异构体有____种
①分子中无环状结构且无支链 ②核磁共振氢谱有两组峰,峰面积之比为3:2其中官能团能与H2发生加成反应的有机物结构简式为_____________(任写一种)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨硼烷(NH3·BH3)电池可在常温下工作,装置如图所示。未加入氨硼烷之前,两极室质量相等,电池反应为NH3·BH3+3H2O2═NH4BO2+4H2O。已知两极室中电解质足量,下列说法正确的是

A. 正极的电极反应式为2H++2![]() ═H2↑
═H2↑
B. 电池工作时,H+通过质子交换膜向负极移动
C. 电池工作时,正、负极分别放出H2和NH3
D. 工作一段时间后,若左右两极室质量差为1.9 g,则电路中转移0.6 mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是
A. NaHCO3溶液与盐酸反应:CO32-+2H+=CO2↑+H2O
B. 足量酸性KMnO4溶液与双氧水反应:2MnO4-+7H2O2+6H+=2Mn2++6O2↑+10H2O
C. NaHSO4溶液中滴加Ba(OH)2溶液至中性:2H++SO42-+2OH-+Ba2+=BaSO4↓+2H2O
D. 往NH4HCO3溶液中加过量的NaOH溶液并加热:NH4++ OH- ![]() NH3 ↑+ H20
NH3 ↑+ H20
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com