
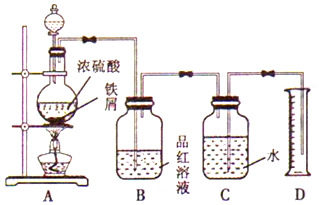
分析 甲乙两实验小组同学对铁及其化合物的性质进行如下探究:
I.(1)装置组装后发生反应除杂、排水量气法测定气体体积,需要气密性完好;
(2)B中观察到品红溶液褪色说明生成气体中含二氧化硫,D中收集到VmL水,说明生成的气体可能含氢气;
II.乙组同学对反应后圆底烧瓶溶液中所含金属离子进行探究,
(3)铁与浓H2SO4的反应过程中必有Fe3+生成,取适量反应后的溶液,加入少量KSCN溶液,不变红色,说明是铁过量和硫酸铁反应生成硫酸亚铁;
(4)取适量反应后的溶液,加人少量酸性高锰酸钾溶液,溶液褪色说明亚铁离子被高锰酸钾溶液氧化;
(5)取少量反应后的溶液,先滴加少量新制氯水,再滴加KSCN溶液,呈现血红色,继续滴加过量新制氯水,红色褪去,可能存在的情况是溶液中Fe3+被氧化程更高价态的铁、溶液中SCN-被氧化或溶液中Fe3+及SCN-均被氧化,可用试剂的反滴加法检验.
解答 解:(1)装置组装后发生反应除杂、排水量气法测定气体体积,需要气密性完好,组装好实验仪器后,接下来的实验操作是检查装罝的气密性,
故答案为:检查装罝的气密性;
(2)浓硫酸和过量的铁在加热条件下反应生成硫酸亚铁和二氧化硫气体,随着反应的进行,硫酸的浓度逐渐降低,稀硫酸和铁反应生成氢气,
故答案为:SO2及H2;
(3)铁与浓H2SO4的反应过程中必有Fe3+生成.取适量反应后的溶液,加入少量KSCN溶液,不变红色.原因是铁过量,反应的离子方程式为:2Fe3++Fe=3Fe2+,
故答案为:2Fe3++Fe=3Fe2+;
(4)取适量反应后的溶液,加人少量酸性高锰酸钾溶液,溶液褪色是亚铁离子被高锰酸钾溶液氧化,该反应原理的离子方程式为:5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O,
故答案为:5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O;
(5)取少量反应后的溶液,先滴加少量新制氯水,再滴加KSCN溶液,呈现血红色,继续滴加过量新制氯水,红色褪去,
①取少量反应后的溶液,先滴加少量新制氯水,再滴加KSCN溶液,呈现血红色,继续滴加过量新制氯水,红色褪去,可能存在的情况是溶液中Fe3+被氧化成更高价态的铁、溶液中SCN-被氧化或溶液中Fe3+及SCN-均被氧化,
故答案为:溶液中SCN-被氧化;溶液中Fe3+及SCN-均被氧化;
②如果是溶液中的+3价铁被氧化为更高的价态,可再加FeCl3溶液,在已褪色的溶液中取出溶液少许于另一试管中,再加入适量的1mol/L的FeCl3溶液;如果溶液红色复原,则结论A正确;反之亦然,
故答案为:在已褪色的溶液中取出溶液少许于另一试管中,再加入适量的1mol/L的FeCl3溶液;如果溶液红色复原,则结论A正确,反之亦然.
点评 本题考查物质的性质实验探究和混合物的计算,为高考常见题型,侧重于学生的分析、实验和计算能力的考查,注意把握实验的方法和端值法的计算的思路,难度中等.


科目:高中化学 来源: 题型:选择题
| 反应时间/min | n(CO)/mol | n(H2O)/mol |
| 0 | 1.20 | 0.60 |
| t1 | 0.80 | |
| t2 | 0.20 |
| A. | 反应在t1min内的平均速率为v(H2)=0.40/t1 mol•L-1•min-1 | |
| B. | 保持其他条件不变,起始时向容器中充入0.60 molCO和1.20 molH2O,到达平衡时,n(CO2)=0.40 mol | |
| C. | 保持其他条件不变,向平衡体系中再通入0.20 mol H2O(g),与原平衡相比,达到新平衡时CO转化率增大,H2O的体积分数增大 | |
| D. | 温度升至800℃,上述反应平衡常数变为1.64,则正反应为吸热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向正反应方向移动 | B. | 向逆反应方向移动 | ||
| C. | 达到平衡 | D. | 无法判断移动方向 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 有机反应中常说的卤化、硝化、水化都属于取代反应 | |
| B. | 按系统命名法,有机物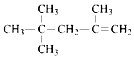 的名称为:2,2,4-三甲基-4-戊烯 的名称为:2,2,4-三甲基-4-戊烯 | |
| C. | 分子式为C8H11N的有机物,分子内含苯环和氨基(-NH2)的同分异构体共14种 | |
| D. | 乙烯、氯乙烯、甲苯三种有机物分子内所有原子均在同一平面 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CCl4和SiC都属于有机物 | |
| B. | 甲醇和乙酸均能与金属钠反应 | |
| C. | C3H6Cl2的同分异构体有3种 | |
| D. | 若分子式为C5H10O2的酯的水解产物之一为乙醇,则该酯的结构有2种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学键 | C-C | C-H | H-H | C-O | C≡O | H-O |
| 键能 (kJ•mol-1) | 348 | 413 | 436 | 358 | 1072 | 463 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 反应时间/min | n(X)/mol | n(Y)/mol |
| 0 | 2.00 | 2.40 |
| 10 | 1.00 | |
| 30 | 0.40 |
| A. | 温度为200℃时,上述反应平衡常数为20,则正反应为吸热反应 | |
| B. | 若密闭容器体积可变,其他条件不变,在达到平衡后缩小容器体积为原来一半,则n(X)>1mol/L | |
| C. | 保持其他条件不变,向容器中再充入1.00molX气体和1.20molY气体,到达平衡后,X转化率增大 | |
| D. | 保持其他条件不变,若再向容器中通入0.10molX气体,0.10molY和0.10molZ,则v(正)<v(逆) |
查看答案和解析>>
科目:高中化学 来源:2017届江西省高三上学期第三次月考化学试卷(解析版) 题型:选择题
铅的冶炼大致过程如下:
①富集:将方铅矿(PbS)进行浮选;
②焙烧 :2PbS+3O2
:2PbS+3O2 2PbO+2SO2;
2PbO+2SO2;
③制粗铅:PbO+C
 Pb+CO;PbO+CO
Pb+CO;PbO+CO Pb+CO2.下列说法正确的是( )
Pb+CO2.下列说法正确的是( )
A.将1  mol
mol  PbS冶炼成Pb理论上至少需要6 g碳
PbS冶炼成Pb理论上至少需要6 g碳
B.浮选法富集方铅 矿
矿 的过程属于化学变化
的过程属于化学变化
C.方铅矿焙烧反 应中,PbS是还原剂,还原产物只有PbO
应中,PbS是还原剂,还原产物只有PbO
D.整个冶炼过程中,制取1 mol Pb共转移2 mol电子
查看答案和解析>>
科目:高中化学 来源:2017届贵州省高三上学期第二次月考化学试卷(解析版) 题型:选择题
如图为二氧化锰的有关转化关系图,有关说法中不正确的是
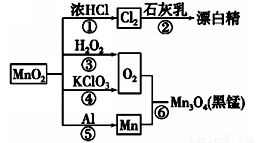
A.反应①~⑥均属于氧化还原反应
B.反应⑤中氧化剂与还原剂的物质的量之比为3∶4
C.相同条件下生成等量的O2,反应③和④转移的电子数之比为1∶2
D.反应②中Cl2只作氧化剂
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com