
 Fe(OH)2+2H+的平衡向逆反应方向移动,从而抑制Fe2+的水解;
Fe(OH)2+2H+的平衡向逆反应方向移动,从而抑制Fe2+的水解;

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
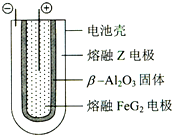 有X、Y、Z、M、G五种元素,是分属三个短周期并且原子序数依次增大的主族元素.其中X、Z同主族,可形成离子化合物ZX;Y、M同主族,可形成MY2、MY3两种分子.完成下列填空:
有X、Y、Z、M、G五种元素,是分属三个短周期并且原子序数依次增大的主族元素.其中X、Z同主族,可形成离子化合物ZX;Y、M同主族,可形成MY2、MY3两种分子.完成下列填空:| 放电 |
| 充电 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
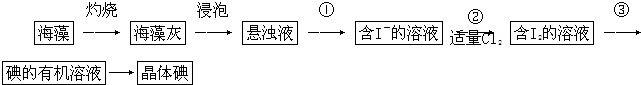
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、区别苯和乙苯:加酸性高锰酸钾溶液,振荡,观察现象 |
| B、检验无水乙醇中是否含有少量水:加硫酸铜晶体观察现象 |
| C、乙醇的消去反应、皂化反应、淀粉的水解反应均可用浓硫酸作催化剂 |
| D、检验氯代烃中的氯元素时,可先加氢氧化钠溶液加热,再加入硝酸溶液,最后加入硝酸银溶液来进行检验 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、使用、制备有毒气体应在通风橱中进行,应有完全吸收处理装置 |
| B、酒精及其它易燃物小面积失火,应该迅速使用湿抹布扑盖;钠、钾等失火应用泡沫灭火器扑灭 |
| C、汞洒落后,应立即撤上硫粉,并打开墙下面的排气扇 |
| D、学生实验时应戴防护眼镜,万一眼睛中溅进酸或碱溶液,应立即用水冲洗(切忌不要用手揉眼睛),然后请医生处理 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、除去乙醛中的乙酸杂质:加入氢氧化钠溶液洗涤,分液 |
| B、检验乙醇中是否含水:用无水硫酸铜,观察是否变蓝色 |
| C、鉴别SO2和Cl2:通入品红溶液,观察是否褪色 |
| D、获得NH4Cl晶体:将NH4Cl溶液蒸发浓缩,冷却结晶,过滤 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、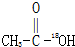 和CH3CH2OH 和CH3CH2OH |
B、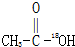 和CH3CH2-18OH 和CH3CH2-18OH |
C、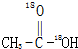 和CH3CH2-18OH 和CH3CH2-18OH |
D、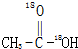 和CH3CH2OH 和CH3CH2OH |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、单位时间内每生成 n mol N2,同时生成2 n mol NO |
| B、容器内反应混合物的总压强不随时间改变 |
| C、O2的消耗速率等于NO的消耗速率 |
| D、容器内始终有N2、O2和NO共存 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com