[化学一物质结构与性质]人类在使用金属的历史进程中,经历了铜、铁、铝之后,第四种将被广泛应用的金属被科学家预测是钛(Ti),它被誉为“未来世纪的金属”.试回答下列问题:
(1)Cu的基态原子的电子排布式为
.
(2)Ti元素在元素周期表中的位置是第
周期第
族;其基态原子的价电子排布为
.
(3)据报道:能“吃废气”的“生态马路”是在铺设时加入一定量的TiO
2,TiO
2受太阳光照射后,产生的电子被空气或水中的氧获得,生成H
2O
2,其过程大致如下:
A.O
2→2O B.O+H
2O→2OH C.OH+OH→H
2O
2B中破坏的是
(填“
σ”或“π”)键.
(4)现代造纸工艺常用钛白粉(TiO
2),钛白粉的一种工业制法是以钛铁矿(主要成分TiFeO
3)为原料按下过程进行的.请配平下列化学方程式
①
FeTiO
3+
C+
Cl
2
TiCl
4+
FeCl
3+
CO
②TiCl
4+O
2TiO
2+2Cl
2(5)Ti晶体的堆积方式是六方最密堆积,则晶体中Ti的配位数为
,空间利用率为
.
(6)在Ti的化合物中,可以呈现+2、+3、+4三种化合价,其中以+4价的Ti最为稳定.
①偏钛酸钡的热稳定性好,介电常数高,在小型变压器、话筒和扩音器中都有应用.偏钛酸钡晶体中晶胞的结
构示意图如图所示,它的化学式是
;
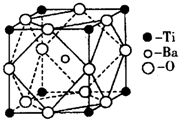
②已知Ti
3+可形成配位数为6的配合物.现有含钛的两种颜色的晶体,一种为紫色,另一种为绿色,但相关
实验证明,两种晶体的组成皆为TiCl
3?6H
2O.为测定这两种晶体的化学式,设计了如下实验:
A.分别取等质量的两种配合物晶体的样品配成待测溶液;
B.分别往待测溶液中滴入AgNO
3溶液,均产生白色沉淀;
C.沉淀完全后分别过滤得两份沉淀,经洗涤干燥后称量,发现原绿色晶体的水溶液与AgNO
3溶液反应得到的白色沉淀质量为紫色晶体的水溶液与AgNO
3溶液反应得到的沉淀质量的
.
则绿色晶体配合物的化学式为
,绿色晶体中含有的化学键类型是
.





