

分析 淡化海水通入氯气,氧化溴离子为单质溴,通入热空气或水蒸气吹出Br2,用碳酸钠溶液吸收溴单质,溴歧化为Br-和BrO3-,其离子方程式为3Br2+6CO32-+3H2O═5Br-+BrO3-+6HCO3-,然后加硫酸酸化:5NaBr+NaBrO3+3H2SO4=3Na2SO4+3Br2+3H2O,得到溴的浓溶液,经萃取、蒸馏、分液,可得到液溴,以此解答.
(1)根据氯气能氧化溴离子得到氯离子和单质溴书写离子方程式;
(2)制备有毒气体的实验时,要及时将气体排出,氯气、溴单质有毒;
(3)用Na2CO3溶液吸收吹出的Br2,生成溴化钠和溴酸钠,同时放出CO2,NaBr化合价降低1,生成NaBrO3化合价升高5,根据化合价升降总数相等和质量守恒配平;(4)化合价升高元素失电子,所在反应物是还原剂,对应产物是氧化产物,化合价降低元素得到电子,所在反应物是氧化剂,对应产物是还原产物,化合价升高数=化合价降低数=转移电子数;
(5)溴的浓溶液,经萃取、分液、蒸馏,可得到液溴;
(6)根据硫酸酸化的方程式5NaBr+NaBrO3+3H2SO4=3Na2SO4+3Br2+3H2O计算.
解答 解:(1)氯气氧化性大于溴单质,氯气可以氧化溴离子为溴单质,离子反应为:2Br-+Cl2═Br2+2Cl-,
故答案为:2Br-+Cl2═Br2+2Cl-;
(2)有毒气体应有完全吸收处理装置,氯气、溴单质有毒,要在通风橱中进行,为了防止中毒,要及时将气体排出,
故答案为:防止中毒;
(3)用Na2CO3溶液吸收吹出的Br2,生成溴化钠和溴酸钠,同时放出CO2,该反应中Br元素化合价由0价变为-1价、+5价,其最小公倍数是5,再结合原子守恒得方程式为:3Br2+3Na2CO3═NaBrO3+5NaBr+3CO2↑,
故答案为:5NaBr;
(4)5NaBr+NaBrO3+3H2SO4=3Br2+Na2SO4+3H2O中,NaBr中Br元素的化合价由-1价升高为0,为还原剂,NaBrO3中Br元素的化合价由+5价降低为0,为氧化剂,电子转移情况为: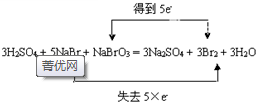 ,
,
故答案为: ;NaBrO3;
;NaBrO3;
(5)溴为易溶于有机溶剂的单质,溴的浓溶液,经萃取、分液、蒸馏,可得到液溴,
故答案为:分液;
(6)加硫酸酸化:5NaBr+NaBrO3+3H2SO4=3Na2SO4+3Br2+3H2O,得到溴的浓溶液,每获得1molBr2,需消耗1ol的硫酸,根据V(H2SO4)=$\frac{n}{c}$=$\frac{1mol}{5mol/L}$=0.2L,
故答案为:0.2L.
点评 本题考查混合物分离提纯的综合应用及海水提溴,为高频考点,把握流程中的反应及混合物分离方法为解答的关键,侧重分析与实验能力的考查,题目难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 试回答下列问题:
试回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
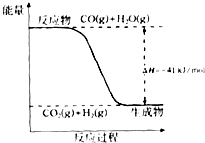 已知一氧化碳与水蒸气反应过程的能量变化如图所示:
已知一氧化碳与水蒸气反应过程的能量变化如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅤⅡA | 0 |
| 2 | C | N | O | |||||
| 3 | Na | Mg | Si | S | Cl | Ar | ||
| 4 | Ca |
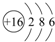 ;其最外层共有6种不同运动状态的电子;
;其最外层共有6种不同运动状态的电子;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;ZX与水反应放出气体的化学方程式为NaH+H2O=NaOH+H2↑.
;ZX与水反应放出气体的化学方程式为NaH+H2O=NaOH+H2↑.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com