
科目:高中化学 来源: 题型:阅读理解

| 11 |
| 4 |
| 1 |
| 2 |
| 11 |
| 4 |
| 1 |
| 2 |
| 32m2 |
| 233m1 |
| 32m2 |
| 233m1 |
| 2.8CV |
| m1 |
| 2.8CV |
| m1 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解

查看答案和解析>>
科目:高中化学 来源:2012届浙江省台州中学高三上学期第三次统练测化学试卷 题型:填空题
(16分)黄铁矿(主要成分为FeS2)是我国大多数硫酸厂制取的主要原料。某化学学习小组对黄铁矿石进行如下实验探究:
[实验一]为测定硫元素的含量
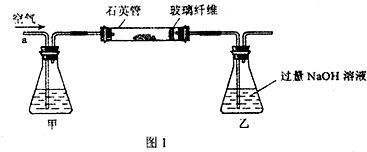
I.将m1g该黄铁矿样品放入如图1所示装置(夹持和加热装置省略)的石英管中,从a处不断地缓缓通入空气,高温灼烧石英管中的黄铁矿样品至反应完全。
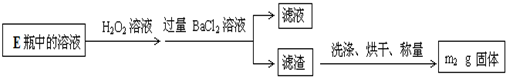
II.反应结束后,将乙瓶中的溶液进行如图2处理。
[实验二]测定铁元素的含量。III。测定铁元素含量的实验步骤如下:
①用足量稀硫酸溶解石英管中的固体残渣;
②加还原剂使溶液中的Fe3+完全转化为Fe2+后,过滤、洗涤;
③将滤液稀释至250mL;
④每次取稀释液25.00mL,用已知物质的量浓度为cmol/L的酸性KMnO4溶液滴定,三次滴定实验所需KMnO4溶液体积的平均值为VmL(该反应中还原产物为Mn2+)
请完成下列填空:
(1)已知12gFeS2完全燃烧放热85.3kJ,则FeS2燃烧热的化学方程式是 。
(2)I中,甲瓶内所盛试剂是 溶液;乙瓶内发生反应的离子方程式有 ;I中玻璃纤维的作用是 。
(3)II中,所加H2O2溶液需足量的理由是 。
(4)III的步骤③中,需要用到的仪器除烧杯、玻璃棒外,还有 ;
(5)该黄铁矿中硫元素的质量分数 (用I、II中有关实验数据表达);该黄铁矿中铁的元素的质量分数 (用I、II中有关实验数据表达)
查看答案和解析>>
科目:高中化学 来源:2011-2012学年浙江省高三上学期第三次统练测化学试卷 题型:填空题
(16分)黄铁矿(主要成分为FeS2)是我国大多数硫酸厂制取的主要原料。某化学学习小组对黄铁矿石进行如下实验探究:
[实验一]为测定硫元素的含量
I.将m,g该黄铁矿样品放入如图1所示装置(夹持和加热装置省略)的石英管中,从a处不断地缓缓通入空气,高温灼烧石英管中的黄铁矿样品至反应完全。

II.反应结束后,将乙瓶中的溶液进行如图2处理。

[实验二]测定铁元素的含量。III。测定铁元素含量的实验步骤如下:
①用足量稀硫酸溶解石英管中的固体残渣;
②加还原剂使溶液中的Fe3+完全转化为Fe2+后,过滤、洗涤;
③将滤液稀释至250mL;
④每次取稀释液25.00mL,用已知物质的量浓度为cmol/L的酸性KMnO4溶液滴定,三次滴定实验所需KMnO4溶液体积的平均值为VmL(该反应中还原产物为Mn2+)
请完成下列填空:
(1)已知12gFeS2完全燃烧放热85.3kJ,则FeS2燃烧热的化学方程式是 。
(2)I中,甲瓶内所盛试剂是 溶液;乙瓶内发生反应的离子方程式有 ;I中玻璃纤维的作用是 。
(3)II中,所加H2O2溶液需足量的理由是 。
(4)III的步骤③中,需要用到的仪器除烧杯、玻璃棒外,还有 ;
(5)该黄铁矿中硫元素的质量分数 (用I、II中有关实验数据表达);该黄铁矿中铁的元素的质量分数 (用I、II中有关实验数据表达)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com