
分析 (1)根据滴定终点,锥形瓶中的溶液颜色发生变化,且半分钟内不褪色;
(2)根据滴定时眼睛应观察锥形瓶内溶液颜色的变化;
(3)根据待测溶液润洗锥形瓶,会使的待测液的物质的量增多;根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$分析误差;
(4)将酸式滴定管用蒸馏水洗净后,立即向其中注入标准稀溶液,则标准溶液的浓度偏小,所以要用标准溶液润洗.
解答 解:(1)用盐酸滴定氢氧化钠溶液以酚酞作指示剂,终点现象是当滴加最后一滴标准液时,溶液由红色变为无色,且30S内不变色;
故答案为:溶液由红色变为无色,并且30S内不变色;
(2)滴定时眼睛应观察锥形瓶内溶液颜色的变化,以判定终点的到达,故选B;
(3)根据待测溶液润洗锥形瓶,会使的待测液的物质的量增多,造成V(标准)偏大,c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$分析,可知c(标准)偏高;
故答案为:待测溶液润洗锥形瓶;偏高;
(4)将酸式滴定管用蒸馏水洗净后,立即向其中注入标准稀溶液,则标准溶液的浓度偏小,所以缺少的操作为:用蒸馏水后再用标准溶液润洗2~3次;
故答案为:用蒸馏水后再用标准溶液润洗2~3次.
点评 本题主要考查了酸碱中和滴定的操作、误差分析等,难度中等,掌握中和滴定的原理是解题的关键.


科目:高中化学 来源: 题型:选择题
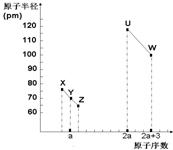 X、Y、Z、U、W五种短周期非金属元素,它们的原子半径与原子序数有如图关系,化合物XZ是水煤气的主要成分之一,下列说法不正确的是( )
X、Y、Z、U、W五种短周期非金属元素,它们的原子半径与原子序数有如图关系,化合物XZ是水煤气的主要成分之一,下列说法不正确的是( )| A. | U、X、W 三种元素最高价氧化物的水化物酸性依次增强 | |
| B. | 由Y、Z和氢三种元素形成的化合物中只有共价键 | |
| C. | XZ2、YZ2与X60的化学键类型和晶体类型都相同 | |
| D. | T元素与U同主族且在下一周期,能形成化合物TW4、TZ2、T3Y4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
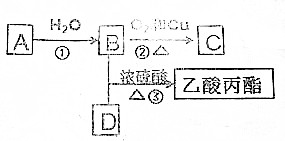
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验操作 | 现象 | 结论 | |
| A | 向盛有25mL沸水的烧杯中滴加5~6滴FeCl3饱和溶液,继续煮沸 | 溶液生成红褐色沉淀 | 制得Fe(OH)3胶体 |
| B | 向两支盛有KI3溶液的试管中,分别滴加淀粉溶液和AgNO3溶液, | 前者溶液变蓝, 后者有黄色沉淀 | KI3溶液中存在平衡: I3-?I2+I- |
| C | 将溴乙烷和NaOH乙醇溶液混合加热,产生气体通入酸性KMnO4溶液 | 酸性KMnO4溶液 褪色 | 一定产生了乙烯 |
| D | 在滴有酚酞的Na2CO3溶液中,加入CaCl2溶液 | 溶液褪色 | CaCl2溶液有酸性 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验编号 | ① | ② | ③ | ④ | ⑤ |
| c(I-)/mol/L | 0.040 | 0.080 | 0.080 | 0.160 | 0.120 |
| c(S2O${\;}_{8}^{2-}$)/mol/L | 0.040 | 0.040 | 0.080 | 0.020 | 0.040 |
| t/s | 88.0 | 44.0 | 22.0 | 44.0 | t1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
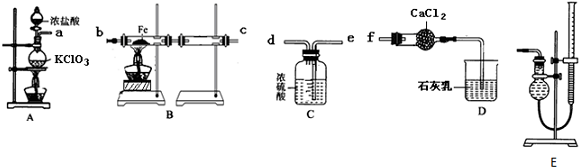
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
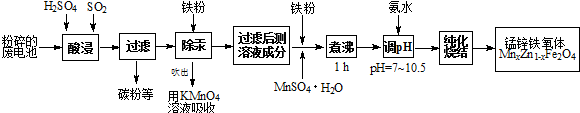
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 浓度/mol•L-1 时间/min | NO | N2 | CO2 |
| 0 | 1.00 | 0 | 0 |
| 10 | 0.58 | 0.21 | 0.21 |
| 20 | 0.40 | 0.30 | 0.30 |
| 30 | 0.40 | 0.30 | 0.30 |
| 35 | 0.32 | 0.34 | 0.15 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:1 | B. | 2:1 | C. | 1:2 | D. | 无法计算 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com