
下列叙述错误的是 ( )
A.标准状况下,5LCH4气体与5LNH3气体的原子个数之比为5:4
B.常温常压下,11.2LO3中所含氧原子个数等于1.5NA
C.同温、同压下,相同体积的N2和CO气体具有 相同的分子数和相同的密度
相同的分子数和相同的密度
D.同温、同压下,等质量的一氧化碳和二氧化碳的密度比为7:11
科目:高中化学 来源:2016届吉林省高三上第三次模拟考试理综化学试卷(解析版) 题型:填空题
AX(g)+2X2(g) AX5(g)在容积为10L恒定不变的密闭容器中进行。起始时AX和X2均为1.3mol,分三组进行实验,每组只改变一个条件且改变条件均不同。反应体系总压强随时间的变化如图所示。(计算结果均保留两位有效数字)
AX5(g)在容积为10L恒定不变的密闭容器中进行。起始时AX和X2均为1.3mol,分三组进行实验,每组只改变一个条件且改变条件均不同。反应体系总压强随时间的变化如图所示。(计算结果均保留两位有效数字)
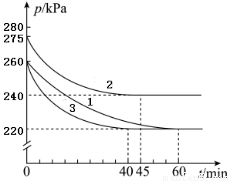
(1)计算实验1反应开始至达到平衡时的反应速率v(AX5)=________________。
(2)图中3组实验从反应开始至达到平衡时的反应速率v(AX5)由大到小的次序为______(填实验序号);
与实验1相比,其他两组改变的实验条件及判断依据是:2____________,3_________。
(3)用p1表示开始时总压强,p2表示平衡时总压强,α表示AX的平衡转化率,则α的表达式为____________;实验1和2的平衡转化率:α1为___________,α2为_________________。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年广西柳州铁路第一中学高二上段考理化学卷(解析版) 题型:实验题
某校化学兴趣小组的同学对一含有少量Na2SO4的NaOH样品中NaOH的含量进行测定。请回答下列问题:
(1)甲同学运用沉淀法测定样品中NaOH的含量。该同学选用的药品除样品外,还应有________;实验中应测定的数据有________。
(2)乙同学运用滴定法测定样品中NaOH的含量。
①用分析天平称取该样品5.000 g,全部溶于水配制成1 000.0 mL溶液。用碱式滴定管量取20.00 mL所配溶液放在锥形瓶中,滴加几滴指示剂,待测。滴定管在使用前除洗涤外,还应________________。
②用浓度为0.100 0 mol·L-1的盐酸标准溶液进行滴定。开始滴定前的一步操作是___ _____。
③滴定过程中用pH计测定锥形 瓶中溶液的pH,临近滴定终点时测定pH应每滴一滴测一次。
瓶中溶液的pH,临近滴定终点时测定pH应每滴一滴测一次。
④滴定过程中,锥形瓶中溶液的pH变化如下:
V(HCl)/mL | 0.00 | 12.00 | 18.00 | 22.00 | 23.00 | 23.96 | 24.00 | 24.04 | 25.00 | 26.00 | 30.00 |
pH | 13.1 | 12.6 | 12.2 | 11.7 | 11.4 | 9.9 | 7.0 | 4.0 | 2.7 | 2.4 | 1.9 |
请在坐标图中绘制出上述中和滴定的曲线。
变色范围(pH) | 颜色 | ||
酸 | 碱 | ||
甲基橙 | 3.1~4.4 | 红 | 黄 |
石蕊 | 5.0~8.0 | 红 | 蓝 |
酚酞 | 8.2~10.0 | 无 | 红 |
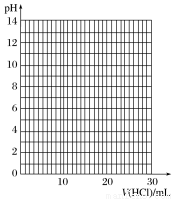
⑤如上表所示是几种酸碱指示剂的变色范围,根据你所作的中和滴定曲线分析,上述中和滴定中应选用的指示剂是________。
⑥样品中,NaOH的质量百分含量为____________。
(3)以下滴定操作能导致最终滴定结果偏低的是( )
A.碱式滴定管取液前尖嘴处有气泡,取液后气泡消失
B.滴定结束后,仰视读取酸式滴定管的数据
C.锥形瓶内盛装待测液之前有少量蒸馏水
D.滴定时,锥形瓶在摇动过程中有液体飞溅出来
E.酸式滴定管使用前未润洗
F.碱式滴定管使用前未润洗
查看答案和解析>>
科目:高中化学 来源:2015-2016学年广西桂林中学高二上期中考试文化学试卷(解析版) 题型:选择题
设 NA为阿伏加德罗常数,下列说法中正确的是( )
A.在常温常压下,22.4 L 氧气所含的分子数目为NA
B.44 g 二氧化碳所含的原子数目为NA
C.18 g 水所含的电子数目为9 NA
D.1 mol 钠作为还原剂所提供的电子数为NA
查看答案和解析>>
科目:高中化学 来源:2015-2016学年广西桂林中学高二上期中考试理化学试卷(解析版) 题型:选择题
若 是烯烃与H2完全加成后的产物,则该烯烃可能有
是烯烃与H2完全加成后的产物,则该烯烃可能有
A.1种 B.2种 C.3种 D.4种
查看答案和解析>>
科目:高中化学 来源:2015-2016学年广东深圳高级中学高二上期中考试化学试卷(解析版) 题型:选择题
常温下,有体积相同的四种溶液:①pH=3的CH3COOH溶液;②pH=3的盐酸;③pH=11的氨水;④pH=11的NaOH溶液。下列说法正确的是
A.①和②混合溶液中:c(H+)=3.0 mol·L-1
B.①和④混合溶液中:c(Na+)=c(CH3COO-)+c(CH3COOH)
C.②和③混合溶液中:c(Cl-)>c(NH4+)
D.四种溶液稀释100倍,溶液的pH:③>④>②>①
查看答案和解析>>
科目:高中化学 来源:2015-2016学年广东广州执信中学高一上期中考试化学试卷(解析版) 题型:选择题
在酸性无色溶液中,下列各组离子一定能大量共存的是
A.MnO4﹣、H+、K+、NO3﹣ B.Na+、H+、Cl﹣、NO3﹣
C.Ba2+、H+、SO42﹣、Cl﹣ D.H+、Mg2+、CO32﹣、Cl﹣
查看答案和解析>>
科目:高中化学 来源:2015-2016学年广东广州执信中学高二上期中理化学试卷(解析版) 题型:填空题
I. 对于弱酸,在一定温度下达到电离平衡时,各微粒的浓度存在一种定量的关系。下表为几种弱酸在25℃时的电离平衡常数
酸 | 电离平衡常数K |
CH3COOH | 1.76×10-5 |
H2CO3 | K1=4.3×10-7 K2=5.61×10-11 |
H3PO4 | K1=7.52×10-3 K2=6.23×10-8 K3=2.20×10-13 |
回答下列问题:
(1)从电离的角度,HCO3-、HPO42-、H2PO4-都可看作是酸,其中酸性最强的是_________,最弱的是________。
(2)等浓度的下列溶液中由水电离出的OH-浓度由大到小的顺序是__(用序号作答)
①CH3COONa ②NaH2PO4 ③NaHPO4 ④NaHCO3 ⑤Na2CO3
(3)电离平衡常数是用实验的方法测定出来的.现已经测得25℃时,c mol/L的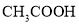 的电离转化率为a,则该温度下醋酸的电离平衡常数KCH3COOH=_____。
的电离转化率为a,则该温度下醋酸的电离平衡常数KCH3COOH=_____。
II.已知t℃时,Kw=1×10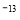 ;在t℃时将pH=11的NaOH溶液aL与pH=1的H2SO4溶液bL混合(忽略混合后溶液体积的变化),若所得混合溶液的pH=2,则 a:b=________。
;在t℃时将pH=11的NaOH溶液aL与pH=1的H2SO4溶液bL混合(忽略混合后溶液体积的变化),若所得混合溶液的pH=2,则 a:b=________。
III.现有含FeCl2杂质的氯化铜晶体(CuCl2·2H2O),为制取纯净的CuCl2·2H2O,首先将其制成水溶液,然后按下图所示步骤进行提纯:
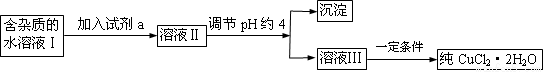
25℃部分阳离子以氢氧化物形式完全沉淀时溶液的pH见下表:
沉淀物 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 |
开始沉淀pH | 2.7 | 7.6 | 4.7 |
完成沉淀pH | 3.2 | 9.7 | 6.7 |
请回答下列问题:
(1)流程中加入的试剂a最合适的是_____________(填序号)
A.酸性高锰酸钾溶液 B.NaClO溶液 C.H2O2溶液 D.稀硝酸
加入试剂a的目的是 。
(2)调节pH约4应该加入的物质可以是 。
A.CuO B.CuCl2 C.Cu(OH)2 D.NaOH
利用平衡移动原理简述加入该物质的理由 。
(3)最后能不能直接蒸发结晶得到CuCl2·2H2O?__________(填“能”或“不能”)。如不能,应如何操作?(若能,此空不填) 。
查看答案和解析>>
科目:高中化学 来源:2016届宁夏回族自治区银川一中高三上第四次月考理化学试卷(解析版) 题型:选择题
下列说法正确的是
A.(NH4)2Fe(SO4)2溶液与过量NaOH溶液反应制Fe(OH)2:Fe2++2OH-=Fe(OH)2↓
B.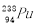 与
与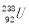 互为同位素
互为同位素
C.H3O+和NH4+具有的电子数相同
D.用BaCl2溶液鉴别AgNO3溶液和K2SO4溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com