
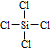 .
.分析 (1)a.同一周期,随着原子序数的增大,原子半径逐渐减小,简单离子半径先减小后增大再减小;
b.同一周期元素,随着原子序数的增大,元素的金属性逐渐减弱,非金属性逐渐增强;
c.元素的金属性越强,其最高价氧化物的水化物碱性越强,元素的非金属性越强,其最高价氧化物的水化物酸性越强;
d.同一周期元素,其单质的熔点先增大后减小;
(2)原子最外层电子数与次外层电子数相同的元素Ar;元素的金属性越强,其简单阳离子的氧化性越弱;
(3)四氯化硅和四氯化碳结构相似,Si和每个Cl原子之间都存在一对共用电子对;
(4)五硫化二磷是酸性氧化物,不能干燥碱性气体,浓硫酸具有强氧化性,不能干燥和浓硫酸反应的气体,具有酸性不能干燥碱性气体;
(5)根据题干信息判断该无氧酸盐为氯化钾,再根据化合价变化判断另一种无氧酸盐名称,最后根据化合价升降相等配平即可.
解答 解:(1)a.第三周期中,随着原子序数的递增,原子半径逐渐减小,而离子半径需要根据阴阳离子进行讨论,阳离子只有2个电子层,随着核电荷数在增大,半径逐渐减小,而阴离子有3个电子层,随着核电荷数的增加逐渐减小,但是阴离子半径整体大于阳离子半径,从阳离子到阴离子,半径在增大,故a错误;
b.同一周期中,随着核电荷数的递增,元素的金属性逐渐减弱,非金属性逐渐增强,故b正确;
c.元素的金属性越强,其最高价氧化物的水化物碱性越强,元素的非金属性越强,其最高价氧化物的水化物酸性越强,所以其最高价氧化物的水化物碱性减弱、酸性增强,故c错误;
d.同一周期元素,其单质的熔点先增大后减小,Si的熔点最高,故d错误;
故答案为:b;
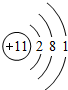
(2)原子最外层电子书与次外层电子数相同,而第三周期中次外层电子为8,该元素原子结构示意图为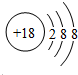 ,则该元素为氩;金属的还原性越强,对应离子的氧化性越弱,所以第三周期中氧化性最弱的为Na+,
,则该元素为氩;金属的还原性越强,对应离子的氧化性越弱,所以第三周期中氧化性最弱的为Na+,
故答案为:氩;Na+;
(3)四氯化硅为共价化合物,氯原子和硅原子都达到8个电子,四氯化硅的电子式为 ,其结构式为
,其结构式为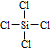 ,故答案为:
,故答案为: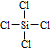 ;
;
(4)a.NH3是碱性气体,和五氧化二磷、浓硫酸都反应,故错误;
b.HI能被浓硫酸氧化而不能用浓硫酸干燥,和五氧化二磷不反应,可以用五氧化二磷干燥,故正确;
c.SO2和浓硫酸、五氧化二磷都不反应,两种物质都能干燥,故错误;
d.CO2和浓硫酸、五氧化二磷都不反应,两种物质都能干燥,故错误;
故选b;
(5)KClO3可用于实验室制O2,若不加催化剂,400℃时分解只生成两种盐,其中一种是无氧酸盐,另一种盐的阴阳离子个数比为1:1,则该无氧酸盐为KCl,KCl中氯元素化合价为-1,说明氯酸钾中氯元素化合价降低,则另一种含氧酸盐中氯元素化合价会升高,由于氯酸钾中氯元素化合价为+5,则氯元素化合价升高只能被氧化成高氯酸钾,根据氧化还原反应中化合价升降相等配平该反应为:4KClO3$\frac{\underline{\;400℃\;}}{\;}$KCl+3KClO4,故答案为:4KClO3$\frac{\underline{\;400℃\;}}{\;}$KCl+3KClO4.
点评 本题考查较综合,涉及同一周期中元素周期律与原子结构的关系、化学方程式的书写等知识,注重高频考点的考查,难点是(5)题方程式的书写,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:多选题
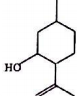
| A. | 其分子式为C10H18O | B. | 含有1个手性碳原子 | ||
| C. | 能发生消去反应 | D. | 可与FeCl3溶液反应显示紫色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在离子化合物里,只存在离子键,没有共价键 | |
| B. | 非极性键只存在于双原子的单质分子中 | |
| C. | 任何物质里都含有化学键 | |
| D. | 在共价化合物分子内,一定不存在离子键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
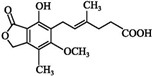
| A. | 分子式为C17H18O6 | B. | 该物质属于脂环化合物 | ||
| C. | 只有两种官能团 | D. | 该物质可发生酯化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| Y | V | |||
| X | W |
| A. | 原子半径:X>W>V>Y | |
| B. | Y的最高价氧化物的电子式为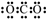 | |
| C. | X的最高价氧化物能与V、W最高价氧化物对应的水化物反应 | |
| D. | 甲、乙混合时所生成的物质为离子化合物,既含有离子键又含有非极性键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| … | E | A | B | ||
| C | … | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲醇 | B. | 甲酸 | C. | 甲醛 | D. | 甲酸甲酯 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com